Ingrese su ID de correo electrónico
FISIOLOGÍA / METABOLISMO / METABOLISMO DE LOS LÍPIDOS
METABOLISMO DE LOS LÍPIDOS
METABOLISMO DE LOS LÍPIDOS
LOS LÍPIDOS SON LOS COMPUESTOS MÁS ENERGÉTICOS DE TODOS LOS NUTRIENTES CON UNA ENERGÍA METABÓLICA DE 9,5 Kcal/gr.
LOS LÍPIDOS ADEMÁS SIRVEN COMO RELLENO ENTRE LOS ÓRGANOS, AMORTIGUADOR, TERMOREGULADOR, SIRVEN COMO VEHÍCULO EN LA ABSORCIÓN DE VITAMINAS LIPOSOLUBRES COMO LA A, E Y K.
TAMBIÉN SON ESENCIALES PARA EL MANTENIMIENTO E INTEGRIDAD DE LAS MEMBRANAS CELULARES. SE REQUIEREN PARA EL ÓPTIMO TRANSPORTE LIPÍDICO (LIGADOS A FOSFOLÍPIDOS COMO AGENTES EMULSIFICANTES). SON FUENTE DE COLESTEROL Y PRECURSORES DE HORMONAS COMO LA VITAMINA D, ANDRÓGENOS, ESTRÓGENOS, CORTICOIDES, MINERALOCORTICOIDES, PROSTAGLANDINAS, ETC. TAMBIÉN ÁCIDOS BILIARES.
TABLA DE CONTENIDO
- Objetivos
- Papel funcional
- Consideraciones generales. Tipos de lípidos en el organismo humano y sus características
- Origen de los lípidos orgánicos y su metabolismo
- Homeostasis de los lípidos
- Referencias
OBJETIVOS
- Comprender cuál es el papel funcional que tienen en el organismo humano.
- Cual es su metabolismo.
- Comprender su regulación homeostática en el sujeto.
PAPEL FUNCIONAL DE LOS LÍPIDOS.
Los lípidos constituyen uno de los tres tipos de nutrientes que forman parte de la dieta del ser humano (hidratos de carbono, proteínas y grasas o lípidos) además de vitaminas, minerales y agua.
Los lípidos o grasas tienen un papel muy importante tanto en la composición del organismo como en su función.
- Reserva de energía del organismo animal. Los lípidos conocidos como triglicéridos constituyen en el cuerpo de los animales (incluido el ser humano) la reserva energética por excelencia. Cuando hay exceso de carbohidratos, se genera grasa que se almacena en el tejido adiposo y luego se transformar, cuando se necesita, en fuente de energía. La oxidación completa de los ácidos grasos proporciona alto contenido calórico, aproximadamente 38 kJ/g (9 kcal/g) kilocalorías al organismo.
- Conformación fenotípica. Los lípidos son utilizados en el organismo para conformar el fenotipo del mismo, distribuyendo la grasa de forma que diferencia al sexo masculino del femenino.
- Colchón mecánico. Los lípidos juegan un papel importante como colchón mecánico para el soporte de los órganos vitales. Recubren órganos y le dan consistencia, o protegen mecánicamente como el tejido adiposo de pies y manos. Ayudan en el mantenimiento de la flotabilidad neutra.
- Protección térmica. La grasa corporal defiende al interior del organismo de la acción del frío ya que a mayor grasa presente menor radiación térmica hacia afuera y, por ende, menor pérdida de calor.
- Papel estructural de las membranas celulares. Los lípidos son esenciales en la constitución de todas las membranas celulares y subcelulares. Forman las bicapas lipídicas de las membranas dándoles fluidez y ejerciendo como elementos activos de las mismas.
- Regulación y comunicación celular. Los lípidos pueden actuar como moléculas de señalización y mensajeros celulares a través de la activación de proteínas acopladas o receptores nucleares[1]Dinasarapu AR, Saunders B, Ozerlat I, Azam K, Subramaniam S (June 2011). "Signaling gateway molecule pages–a data model perspective". Bioinformatics. 27 (12): 1736–8. doi:10.1093/bioinformatics/btr190. PMC 3106186. PMID 21505029.. Entre ellos se encuentra la esfingosina-1-fosfato, un esfingolípido derivado de la ceramida que es una potente molécula mensajera implicada en la regulación de la movilización del calcio, el crecimiento celular y la apoptosis; el diacilglicerol (DAG) y los fosfatidilinositol fosfatos (PIP), que participan en la activación mediada por el calcio de la proteína quinasa C[2]KLEIN, Eric A.; ASSOIAN, Richard K. Transcriptional regulation of the cyclin D1 gene at a glance. Journal of cell science, 2008, vol. 121, no 23, p. 3853-3857.; las prostaglandinas, que son un tipo de eicosanoide derivado de los ácidos grasos que participa en la inflamación y la inmunidad; las hormonas esteroides como el estrógeno, la testosterona y el cortisol, que modulan una serie de funciones como la reproducción, el metabolismo y la presión arterial; y los oxisteroles como el 25-hidroxicolesterol que son receptores X del hígado agonistas[3]Bełtowski J. Liver X receptors (LXR) as therapeutic targets in dyslipidemia. Cardiovasc Ther. 2008 Winter;26(4):297-316. doi: 10.1111/j.1755-5922.2008.00062.x. PMID: 19035881.. También los lípidos de la fosfatidilserina participan en la señalización para la fagocitosis de las células apoptóticas o de trozos de células.
- Nutrientes esenciales. Las vitaminas "liposolubles" (A, D, E y K).
- Transporte. En conjunto con ácidos biliares y lipoproteínas, los lípidos van desde los intestinos a sus distintos destinos y sirven de transporte a otros nutrientes.
- Precursores de la vitamina D3, los ácidos biliares y hormonas esteroidesandrógenos, estrógenos, hormonas adrenales y corticosteroides.
- Otras funciones. Las acilcarnitinas intervienen en el transporte y el metabolismo de los ácidos grasos dentro y fuera de las mitocondrias, donde se someten a la beta oxidación[4]Indiveri C, Tonazzi A, Palmieri F (October 1991). «Caracterización del transporte unidireccional de carnitina catalizado por el transportador de carnitina reconstituido de mitocondrias de hígado de rata». Biochimica et Biophysica Acta (BBA) – Biomembranas 1069 (1): 110-6. PMID 1932043. doi:10.1016/0005-2736(91)90110-t.. Los poliprenoles y sus derivados fosforilados también desempeñan importantes funciones de transporte, en este caso el transporte de oligosacáridos a través de las membranas. Los azúcares fosfato de polprenol y los azúcares difosfato de polprenol funcionan en las reacciones de glicosilación extra citoplasmática, en la biosíntesis de polisacáridos extracelulares (por ejemplo, la polimerización del peptidoglicano en las bacterias) y en la N-glicosilación de las proteínas eucariotas[5]Parodi, A.J. "The mechanism of synthesis of the polysaccharide part of mannan in Saccharomyces cerevisiae" . Archives of Biochemistry and Biophysics, vol. 210, no. 1, 1981, pp. 372-382. http://dx.doi.org/10.1016/0003 9861(81)90200-9[6]Intracellular functions of N-linked glycans A Helenius, M Aebi Science 291 (5512), 2364-2369.Las cardiolipinas son una subclase de glicerofosfolípidos que contienen cuatro cadenas de acilo y tres grupos de glicerol que son particularmente abundantes en la membrana mitocondrial interna[7]Gohil, V.M. and Greenberg, M.L. (2009) Mitochondrial Membrane Biogenesis: Phospholipids and Proteins Go Hand in Hand. Journal of Cell Biology, 184, 469-472. https://doi.org/10.1083/jcb.200901127. Se cree que activan las enzimas implicadas en la fosforilación oxidativa.
LÍPIDOS. CONSIDERACIONES GENERALES. TIPOS DE LÍPIDOS EN EL SER HUMANO Y CARACTERÍSTICAS
Un lípido (también mal conocido como grasa) se define como un compuesto orgánico formado por una cadena de átomos de carbono, hidrógeno y oxígeno (también puede tener fósforo, nitrógeno y azufre) insoluble en agua, pero soluble en solventes orgánicos.
Se pueden clasificar en dos grupos: Basados en el glicerol y los no basados en el glicerol.
- Basados en el glicerol
- Simple
- Grasas y aceites: Son los triacilglicéridos (TG) y los ácidos grasos libres (AGL). Forman parte del almacenamiento energético del sujeto en forma de TG. Los ácidos grasos que proceden del catabolismo de los TG pueden ser resterificados para volver a formar TG, sobre todo en el tejido adiposo o utilizados para sintetizar otros lípidos importantes para el organismo, de lo que se encarga el hígado. Representan la principal fuente energética dietética en la nutrición de un sujeto. Las grasas o TG depositadas en los tejidos, principalmente el tejido adiposo, representan el almacén principal de energía potencial del cuerpo. Las reservas reales de combustible disponibles en la grasa almacenada representan unos 90.000Kcal a 110000Kcal de energía mientras que los carbohidratos solo 1500Kcal como glucógeno muscular, 400Kcal como glucógeno hepático y 80Kcal glucosa en líquidos extracelulares[8]McArdle W, Katch F, Katch V. Fundamentos de Fisiología del Ejercicio. Pág. 110-111.. Como sustrato energético aporta 9,5 Kcal/gr. Estas reservas de las grasas representa entre el 18 y el 30 % de la masa corporal en adultos no obesos.
VER TABLA DE LOS ÁCIDOS GRASOS EN EL HOMBRE
 .
.En el cuerpo humano, las células pueden obtener ácidos grasos combustibles a partir de tres fuentes: grasas consumidas en la dieta, grasas acumuladas en la célula y grasas sintetizadas en el hígado y que se exportan a otros órganos. El tejido adiposo puede proveer los TAG almacenados en pequeñas gotas lipídicas, para cubrir más de la mitad de las necesidades energéticas de algunos órganos, tales como el hígado, corazón y músculo esquelético. Las gotas de lípidos (LIPOPROTEÍNAS) son de estructura esférica compuesta de un núcleo de lípidos neutros recubierta por una monocapa de fosfolípidos, dentro de la cual están embebidas proteínas específicas (APOPROTEINAS).
- ÁCIDOS GRASOS SATURADOS E INSATURADOS
- Los ácidos grasos saturados son aquellos cuyos enlaces entre carbonos son sencillos. La función principal de estas grasas es proporcionar energía y, de hecho, son más fáciles de metabolizar por nuestras células que cualquier grasa insaturada. Además, cuando hay exceso de energía, nuestras células fabrican grasas saturadas y las almacenan en el tejido adiposo, de ahí el color blanco amarillento de los adipocitos.
La sustitución de ácidos grasos saturados por poliinsaturados (oliva, cacahuete, canola, etc.) disminuye la concentración de colesterol-LDL y el cociente colesterol total / colesterolHDL (“colesterol bueno”). Efectos similares, aunque algo menores se consiguen cuando la sustitución se hace por ácidos grasos monoinsaturados (Figura 1).

Figura 1: Ácidos grasos saturados e insaturados.
- Los ácidos grasos insaturados poseen uno o más dobles enlaces en su molécula, pudiendo ser monoinsaturados o poliinsaturados respectivamente.
- Los monoinsaturados tienen un solo enlace doble como el ácido oleico, con un doble enlace en posición n-9 (omega-9).
- Los poliinsaturados tienen de 2 a 6 dobles enlaces. Los más importantes son el ácido alfalinolénico (ALA) de la serie omega-3 y el ácido linoleico (AL) de la serie omega-6. Son ácidos grasos esenciales que deben ingerirse con la dieta. Ambos tienen importantes funciones en el organismo al ser precursores de sustancias como prostaglandinas, leucotrienos y prostaciclinas que intervienen en la regulación de la presión sanguínea, la función renal, la coagulación o la inflamación. Además son esenciales en diversas funciones de las membranas celulares como la permeabilidad y la actividad de enzimas y receptores de membrana. Por eso, en la dieta es importante mantener una proporción equilibrada de la ingesta de ambos tipos de ácidos grasos.
- ÁCIDOS GRASOS CIS Y TRANS
Un ácido graso cis es un ácido graso insaturado que posee los grupos semejantes o idénticos (generalmente grupos –H) en el mismo lado de un doble enlace. Los ácidos grasos cis son isómeros de los ácidos grasos trans (AGT), en los que los –H se disponen uno a cada lado del doble enlace.
Los ácidos grasos insaturados naturales, tienen una configuración casi invariablemente del tipo cis. Sin embargo, la biohidrogenación en el rumen de ganado bovino u ovino, o la hidrogenación industrial de aceites vegetales, convierten algunos de los ácidos grasos insaturados cis en ácidos grasos trans. La ingesta de los AG trans tienen efectos adversos sobre los lípidos sanguíneos y son más aterogénicos que los ácidos grasos saturados, ya que éstos no solo aumentan la concentración de colesterol total (Ct), de las lipoproteínas de baja densidad (LDLc) y triglicéridos, sino que disminuyen la concentración de las lipoproteínas de alta densidad (HDLc) y aumentan notablemente la relación LDLc/HDLc, la cual es un fuerte marcador de riesgo de ECV; a diferencia de los ácidos grasos saturados que sólo elevan la concentración de colesterol LDL sin reducir el colesterol HDL[9]Ascheiro A, Willet W C. Health effects of trans fatty acids. Am J Clin Nutr.1997;66: 1006S-39S.[10]Willet WC. Intake of trans fatty acids and risk of coronary heart disease among women. Lancet. 1993; 341: 581-85..
- ÁCIDOS GRASOS CIS Y TRANS
- Los ácidos grasos saturados son aquellos cuyos enlaces entre carbonos son sencillos. La función principal de estas grasas es proporcionar energía y, de hecho, son más fáciles de metabolizar por nuestras células que cualquier grasa insaturada. Además, cuando hay exceso de energía, nuestras células fabrican grasas saturadas y las almacenan en el tejido adiposo, de ahí el color blanco amarillento de los adipocitos.
- ÁCIDOS GRASOS ESENCIALES
El organismo humano es capaz de sintetizar todos los ácidos grasos necesarios para su metabolismo excepto dos ácidos que pertenecen a la serie de los ácidos poliinsaturados OMEGA 3 y OMEGA 6. En los OMEGA 3 se destacan: el ácido eicosapentaenoico (EPA), el ácido docosahexaenoico (DHA) y el alfalinolénico (ALA). Mientras que en la serie OMEGA 6 tenemos el ácido gammalinolénico (GLA), el ácido araquidónico (AA) y linoleico (LA). De todos éstos el alfalinolénico y el linoleico no pueden ser sintetizados por el organismo, por lo que deben ser aportados en la dieta. Por ese motivo se denominan ácido grasos esenciales (AGE). El resto son de difícil síntesis endógenas y por eso es bueno que formen también parte de la dieta, dadas las importantes funciones que tienen[11]David Aires, Núria Capdevila, María José Segundo. Ácidos grasos esenciales. Vol. 24. Núm. 4, páginas 96-102 (Abril 2005)- -El EPA es un ácido graso básico para la regulación de la funcionalidad cerebral (señal celular y riego sanguíneo neuronal), el desarrollo óptimo del cerebro y la vista, y la síntesis de las prostaglandinas (PGA3). Puede convertirse fácilmente en DHA si es necesario.
- -El DHA es un ácido graso estructural, pues forma parte de las membranas celulares y es también importante para el desarrollo visual durante la gestación y la primera infancia.
- -El GLA es un ácido graso estructural, ya que es un importante componente de la membrana celular, y también es precursor de las prostaglandinas (PGA1).
- -El AA es un ácido graso básico para la síntesis de ciertas prostaglandinas (PGA2).
- ÁCIDOS GRASOS SATURADOS E INSATURADOS
- Grasas y aceites: Son los triacilglicéridos (TG) y los ácidos grasos libres (AGL). Forman parte del almacenamiento energético del sujeto en forma de TG. Los ácidos grasos que proceden del catabolismo de los TG pueden ser resterificados para volver a formar TG, sobre todo en el tejido adiposo o utilizados para sintetizar otros lípidos importantes para el organismo, de lo que se encarga el hígado. Representan la principal fuente energética dietética en la nutrición de un sujeto. Las grasas o TG depositadas en los tejidos, principalmente el tejido adiposo, representan el almacén principal de energía potencial del cuerpo. Las reservas reales de combustible disponibles en la grasa almacenada representan unos 90.000Kcal a 110000Kcal de energía mientras que los carbohidratos solo 1500Kcal como glucógeno muscular, 400Kcal como glucógeno hepático y 80Kcal glucosa en líquidos extracelulares[8]McArdle W, Katch F, Katch V. Fundamentos de Fisiología del Ejercicio. Pág. 110-111.. Como sustrato energético aporta 9,5 Kcal/gr. Estas reservas de las grasas representa entre el 18 y el 30 % de la masa corporal en adultos no obesos.
- Compuesto
- Glucolípidos: Los glucolípidos, también llamados esfingoglucolípidos, están compuestos por una ceramida (esfingosina + ácido graso) y un glúcido de cadena corta; carecen de grupo fosfato. Los glucolípidos forman parte de la bicapa lipídica de la membrana celular; la parte glucídica de la molécula está orientada hacia el exterior de la membrana plasmática y es un componente fundamental del glicocálix, donde actúa en el reconocimiento celular y como receptor antigénico.
- Fosfolípidos
- Lecitinas: La lecitina, también conocida como fosfatidilcolina, es un fosfolípido formado principalmente por ácidos grasos, glicerol, ácido fosfórico y colina.
 Se encuentra en las yemas de huevos, las habas de soja, las semillas de girasol y en las células de las semillas de las plantas. Las lecitinas de soja y girasol contienen muchos más ácidos grasos esenciales que la lecitina de colza y por tanto, son más valiosas desde un punto de vista nutricional. Las principales funciones de la lecitina son estabilizar las membranas celulares, estimular diversos procesos metabólicos, respaldar la regeneración de células hepáticas y muchas otras.
Se encuentra en las yemas de huevos, las habas de soja, las semillas de girasol y en las células de las semillas de las plantas. Las lecitinas de soja y girasol contienen muchos más ácidos grasos esenciales que la lecitina de colza y por tanto, son más valiosas desde un punto de vista nutricional. Las principales funciones de la lecitina son estabilizar las membranas celulares, estimular diversos procesos metabólicos, respaldar la regeneración de células hepáticas y muchas otras. - Cefalinas: Es un fosfolípido presente en las membranas celulares, uno de los más abundantes en los tejidos humanos.
 Está compuesta por un glicerol esterificado en los hidroxilos 1 y 2 por dos ácidos grasos, y en el hidroxilo 3 con un grupo fosfato que, a su vez, se esterifica con el aminoalcohol etanolamina, un derivado del etanol. La fosfatidiletanolamina posee mayoritariamente ácido palmítico, ácido esteárico u ácido oleico en posición 1 y un ácido graso poliinsaturado de cadena larga, como el ácido araquidónico, en posición 2. Es, junto con la fosfatidilcolina, uno de los fosfolípidos más frecuentes en la bicapa lipídica de las membranas celulares.
Está compuesta por un glicerol esterificado en los hidroxilos 1 y 2 por dos ácidos grasos, y en el hidroxilo 3 con un grupo fosfato que, a su vez, se esterifica con el aminoalcohol etanolamina, un derivado del etanol. La fosfatidiletanolamina posee mayoritariamente ácido palmítico, ácido esteárico u ácido oleico en posición 1 y un ácido graso poliinsaturado de cadena larga, como el ácido araquidónico, en posición 2. Es, junto con la fosfatidilcolina, uno de los fosfolípidos más frecuentes en la bicapa lipídica de las membranas celulares.
- Lecitinas: La lecitina, también conocida como fosfatidilcolina, es un fosfolípido formado principalmente por ácidos grasos, glicerol, ácido fosfórico y colina.
- Simple
- Basados en compuestos diferentes al glicerol
- Ceras: Son ésteres de un ácido graso de cadena larga con un alcohol monovalente lineal de cadena larga. Sólidos a temperatura ambiente, poseen sus dos extremos hidrófobos, lo que determina su función impermeabilizante y protectora. En el ser humano el cerumen auditivo.
- Cerebrósidos: Tipo de esfingolípidos en el que la ceramida está unida a un monosacárido neutro, generalmente galactosa (galactocerebrósido) y abunda en las membranas plasmáticas de los músculos y células nerviosas. Los glucosilcerebrósidos son encontrados solamente en células de tejidos no nerviosos y pueden llegar a representar el 2 % del peso deshidratado de la materia gris y el 12 % de la materia blanca. Son el principal constituyente de los oligodendrocitos. Son abundantes, al igual que las esfingomielinas, en las vainas mielínicas que rodean los axones de algunas neuronas[12]https://es.wikipedia.org/wiki/Cerebrósido.
Los galactosilcerebrósidos están presentes en todos los tejidos nerviosos. - Esteroles: El colesterol es el principal y el más importante. Se encuentran en el reino animal y en el mundo vegetal (por ejemplo, el sitosterol) y en hongos y levaduras (por ejemplo, el ergosterol)[13]https://www.elsevier.es/es-revista-clinica-e-investigacion-arteriosclerosis-15-articulo-la-utilizacion-esteroles-vegetales-practica-S0214916816300274#bib0510. Los esteroles que derivan de los vegetales los llamamos fitoesteroles.
Los esteroles son constituyentes de las membranas celulares, sirven como precursores para una variedad de productos con actividades biológicas específicas (por ejemplo, las hormonas esteroides) y también de ellos derivan los ácidos biliares que actúan como detergentes de las grasas de la dieta en el intestino para que estas sean más fácilmente accesibles a las lipasas digestivas y continúe así el proceso de absorción. - Terpenos: Los terpenos son compuestos orgánicos aromáticos que se encuentran en las plantas y en los alimentos y provienen de derivaciones del isopreno (hidrocarburo con 5 átomos de carbono). Dan coloración a los órganos vegetales y participa en la síntesis de las vitaminas A, K y E. Actúan como antioxidantes que protegen los lípidos, la sangre y los demás fluidos corporales del ataque de los radicales libres.
- Esfingomielinas: Forman parte de las membranas plasmáticas de las células animales, en la vaina de mielina que recubre y aísla los axones de las neuronas mielinizadas. Están compuestas por la ceramida, un ácido ortofosfórico y una molécula con grupo alcohol, como un aminoalcohol.

Figura 2: Tipos de lípidos.
ORIGEN DE LOS LÍPIDOS EN EL ORGANISMO HUMANO. METABOLISMO
Los lípidos que encontramos en el organismo humano proceden de dos orígenes: uno EXÓGENO, proveniente de la dieta. Y el otro ENDÓGENO, proveniente del HÍGADO, TEJIDO ADIPOSO Y GLÁNDULAS MAMARIAS LACTANTES.
Figura 3: Origen de los lípidos endógenos.
Los que provienen de la dieta son transportados desde el sistema digestivo al hígado en su forma soluble: QUILOMICRÓN (QM). Y en el hígado son sometidos a su lipólisis, llegando como QM o/y como IDL (LIPOPROTEÍNA INTERMEDIA) que se forma a medida que el QM pierde contenido por acción de las lipasas plasmáticas.
Los endógenos provienen de la lipogénesis que se realiza preferentemente en el hígado (principal responsable de la síntesis del colesterol endógeno), tejido adiposo, tejido muscular esquelético y coronario y en las glándulas mamarias durante la lactancia.
Su distribución en el organismo es la siguiente:
LÍPIDOS PLASMÁTICOS (0,5mMol)
LÍPIDOS INTRAMUSCULARES (300mMol)
LÍPIDOS EXTRAMUSCULARES (17.500mMol)
En el hombre, entre el 95 y el 98 % del total de los ácidos grasos presentes en el plasma sanguíneo están contenidos en los ésteres de ácidos grasos como los triglicéridos, los fosfolípidos y los ésteres del colesterol. Estos ésteres de ácidos grasos, por su insolubilidad en el citoplasma y en el plasma sanguíneo, se encuentran formando complejos con fosfolípidos y proteínas (lipoproteínas) sintetizadas por el propio hígado y así se encuentran en el torrente circulatorio. El resto, una pequeña porción de entre un 2 y 5 %, se hallan en forma no esterificada y están unidos a un complejo albuminoide del plasma. Una concentración de ácidos grasos no esterificados (AGNE) > 2mmol/L en el plasma, es tóxica para el organismo humano.

El metabolismo de los lípidos está sujeto a los procesos de CATABOLISMO, donde los productos son utilizados (AGL) para, mediante la beta-oxidación, convertirlos en energía química (ATP) o, como sustratos intermediarios para generar otros compuestos fundamentales de la estructura y función de las células (AGL, COLESTEROL, FOSFOLÍPIDOS (PHP), ETC.). Y ANABOLISMO, donde todas las células del organismo tienen capacidad enzimática para fabricar los lípidos, pero es el HÍGADO, el principal productor junto con el tejido adiposo, el muscular, el cardíaco y las glándulas mamarias durante la lactación.
El catabolismo lipídico se conoce como LIPÓLISIS y el anabolismo como LIPOGÉNESIS. Y entre éstos hay un equilibrio regulado homeostáticamente.
Figura 4: Relación lipólisis-lipogénesis.
ORIGEN EXÓGENO DE LOS LÍPIDOS EN EL ORGANISMO HUMANO. APORTE DIETÉTICO
El contenido graso de una dieta normal está formado principalmente, por triglicéridos (98%) y pequeñas cantidades de esteroles, éster de esteroles y fosfolípidos, así como vitaminas liposolubles (A, D, E y K). La capacidad máxima de absorción grasa del intestino delgado, en un período de 24 horas es de 700 gramos para los triglicéridos y de 4 gramos para el colesterol.
DIGESTIÓN Y ABSORCIÓN INTESTINAL
Los lípidos son poco solubles en la interfase acuosa del sistema digestivo, por lo que plantean un serio problema para su digestión enzimática en dicha interfase. En el estómago tienden a separarse en una gran fase oleosa que por los fuertes movimientos gástricos se emulsiona en pequeñas gotas grasas. Pero en el intestino delgado son emulsionados gracias a la presencia de las sales biliares, con las que forman las micelas. Estas micelas incluyen en su interfase hidrófoba a los lípidos, disgregando la emulsión grasa proveniente del estómago, de forma análoga al efecto de un detergente sobre una capa grasa. Este efecto detergente se ve favorecido por la presencia de un medio alcalino, y se incrementa a medida que el contenido de productos lipolíticos es mayor. Este disgregamiento incrementa la superficie de ataque de las enzimas lipolíticas de origen pancreático las cuales, a pesar de ser hidrosolubles, se incluyen en estas micelas, favorecidas por la presencia de un cofactor que incrementa dicha inclusión, como ocurre con la lipasa pancreática y su cofactor la colipasa. Las gotas de emulsión así formadas son de aproximadamente 1 µm de diámetro.
La digestión de los lípidos empieza con la secreción salivar, mediante la lipasa salival…
TRANSPORTE PLASMÁTICO DESDE EL INTESTINO AL HÍGADO
Los enterocitos en su proceso de la digestión de los lípidos de la dieta, procesan y producen nuevamente los TG, colesterol y otros lípidos bien por re-esterificación de los absorbidos o bien por síntesis de novo a partir de los ácidos grasos absorbidos y el alfa-glicerofosfato. Además, en el mismo retículo endoplásmico, donde se realiza todo este proceso de síntesis y resíntesis de lípidos, también se sintetizan apoproteínas que van conformando el receptáculo donde se engloban dichos lípidos para luego ser excretados a la circulación linfática en forma de lipoproteínas denominadas quilomicrones nacientes (QMn) (Ver metabolismo de los quilomicrones más adelante).
LÍPIDOS ENDÓGENOS. TEJIDOS PRODUCTORES
Aunque todas las células del organismo tienen la capacidad de sintetizar lípidos, es en el hígado, tejido adiposo y glándulas mamarias lactantes donde se realiza preferentemente el metabolismo anabólico de los lípidos, siendo de todos ellos el principal productor el hígado. Ésta síntesis puede ser a partir de novo o a partir de los ácidos grasos procedentes del plasma.
LIPOGÉNESIS. SÍNTESIS DE ÁCIDOS GRASOS <= 16 C
La biosíntesis de ácidos grasos se realiza en el citoplasma de las células del hígado, riñón, cerebro, tejido adiposo, glándula mamaria y pulmón. El principal sustrato es la glucosa (en rumiantes es el ácido acético) que tras la glucólisis se obtiene el actil-CoA (Ver figura). Son tres las fases de esta biosíntesis:
- Salida del Acetil-CoA desde la mitocondria al citosol.
- Obtención del Malonil-CoA a partir del Acetil-CoA. Por intermedio de la enzima Acetil-CoA carboxilasa, que es el paso limitante en la biosíntesis de ácidos grasos.
- Síntesis del ácido graso.
El acetil-CoA es la fuente de todos los carbonos del ácido graso en síntesis. El exceso de acetil-CoA, en dietas muy calóricas, se utiliza para la formación de ácidos grasos y la formación de TAG que serán almacenados.
El proceso depende de la energía contenida en los enlaces del ATP, del poder reductor del NADPH (usualmente derivado de la ruta de las pentosas fosfato), del cofactor biotina, de iones bicarbonato (HCO3-) y de iones de manganeso.
El principal producto de esta biosíntesis es el palmitato (16C), aunque en la glándula mamaria es el decanoico (cáprico, 10C)
ETAPA 1: El acetil-CoA se produce en las mitocondrias y no puede pasar la membrana mitocondrial (figura 5). Para conseguirlo necesita unirse al oxalacetato. Una vez en el citosol el acetil-CoA puede tener varios destinos:
- Gluconeogénesis: síntesis de glucosa a partir de precursores no glucídicos.
- Biosíntesis de ácidos grasos.
- Biosíntesis de aminoácidos.
- Síntesis del neurotransmisor acetilcolina (de gran importancia en las placas motoras, para estimular las contracciones musculares), con ayuda de la colina y una enzima específica que cataliza la unión.
Figura 5: Procedencia del Acetil-CoA para la síntesis de ácidos grasos. Etapa inicial.
ETAPA 2.
La etapa 2 (figura 6) ocurre en el citoplasma con la intervención de la enzima Acetil-CoA carboxilasa (ACAC), complejo enzimático formado por 4 proteínas y que utiliza biotina como cofactor[14]En el ser humano existen dos isozimas de la acetil-CoA carboxilasa llamadas alfa (ACACA) y beta (ACACB). La isozima alfa participa en la biogénesis de los ácidos grasos de cadena larga mientras que la isozima beta participa en la provisión de malonil-CoA y en la regulación de la oxidación de los ácidos grasos.La isozima alfa se expresa en el cerebro, placenta, músculo esquelético, riñones, páncreas y tejidos adiposos. Se expresa en un bajo nivel … Continúe leyendo además del bicarbonato como dador de carbono y el ATP, se forma malonil-CoA.
Esta etapa es la que determina la biosíntesis o no de los AGNE, ya que cuando existe suficiente cantidad de “combustible metabólico”, el exceso es convertido en ácidos grasos que son almacenados para su posterior oxidación en momentos de déficit energético. La enzima está bajo el control del citrato, glutamato y otros ácidos dicarboxílicos que la activan. Cuando las concentraciones mitocondriales de acetil-CoA y de ATP incrementan, el citrato es transportado hacia el citosol, donde actúa como precursor para la síntesis citosólica de acetil-CoA y como una señal alostérica de activación para la acetil-CoA carboxilasa. Por otra parte, es inhibida por el palmitoil-CoA, el principal producto de la síntesis.
Así mismo, esta enzima se inactiva cuando se fosforila, efecto que realizan tanto el glucagón como la adrenalina circulantes y sobre todo por la activación de la proteína kinasa activada por AMP (AMPK) que es el principal regulador kinasa de la isozima ACACB. La insulina sin embargo, activa una fosfatasa que defosforila la enzima causando su activación[15]McGenity, T., Van Der Meer, J. R., & de Lorenzo, V. (2010). Handbook of hydrocarbon and lipid microbiology (p. 4716). K. N. Timmis (Ed.). Berlin: Springer..
Figura 6: Biosíntesis de los AGNE. ETAPA 2.
ETAPA 3. ACCIÓN DE LA ÁCIDO GRASO SINTASA
El acetil-CoA y el malonil-CoA forman parte de la ruta de síntesis con la sintasa de ácido graso (AGS), la cual empieza por el extremo metileno y termina en el extremo carboxilo. Esta enzima es un complejo formado por siete enzimas y un transportador, dispuestos en dos grandes subunidades. Una es la 4-fosfopanteteina (PPant-SH) la cual proporciona un grupo sulfhidrilo a la cadena creciente de ácido graso. La otra subunidad es la cisteinil-sulfhidrilo (Cys-SH) o subgrupo condensador.
Esta enzima es una proteína multifuncional formada por siete dominios, dispuestos de la siguiente forma de acuerdo a su actividad funcional en la síntesis del ácido graso (Ver figura de su estructura):
– Actividades Malonil/Acetil Transacilasa (MAT)
– Actividad β-Cetoacil-Sintasa (KS)
– Actividad β-Hidroxiacil-Deshidratasa (DH)
– Actividad Enoil-Reductasa (ER)
– Actividad β-Cetoacil-Reductasa (KR)
– Actividad Tioesterasa (TE)
– “Acil carrier protein” (ACP), proteína portadora de acilos unida por una Serina al grupo prostético 4’ fosfopanteteína que une los ácidos grasos mientras se van alargando y los va llevando desde una reacción a otra durante su síntesis.
– Y dos dominios no enzimáticos denominados pseudometiltransferasa ( ψME) y pseudocetoreductasa (ψKR).
La síntesis del ácido graso se realiza en cuatro fases, todas dentro de la misma enzima, con una fase inicial (ENLACES TIOÉSTER) fundamental, donde los dos grupos tiol (SH) (del ACP y KS) deben cargarse con los acilos correctos. El grupo acilo del acetil-CoA pasa al grupo tiol del dominio KS, catalizado por el domino MAT (malonil-acetil-CoA-ACP transacetilasa) y el malonil-CoA se une al grupo tiol del conjunto ACP.
Figura 7: Biosíntesis de ácidos grasos <= 16 C. Fase 1 y 2.
Una vez realizado el paso anterior se produce la CONDENSACIÓN (PRIMERA FASE) donde el grupo acetilo es transferido por el dominio KS (β-cetoacil-sintasa) al malonil ligado al SH del ACP, liberándose CO2.
SEGUNDA FASE: REDUCCIÓN; Se reduce el grupo carbonilo beta, gracias a la actividad catalítica del dominio KR (β-cetoacil-ACP-reductasa), transformándose en un grupo hidroxilo. Se necesita un NADPH.

Figura 8: Biosíntesis de ácidos grasos <= 16 C. Fases 3, 4 y 5.
TERCETRA FASE: DESHIDRATACIÓN: Por la intervención del dominio DH, con actividad deshidratasa (β-hidroxiacil-ACP deshidratasa), se elimina una molécula de agua y se forma un doble enlace entre los carbonos alfa y beta.
CUARTA FASE: REDUCCIÓN: Este doble enlace se reduce aún simple enlace por la actividad REDUCTASA (enoil-ACP reductasa) del dominio ER con gasto de un NADPH.
Esta nueva molécula de cuatro carbonos (ácido butírico) es transferida desde la ACP hasta el resto Cys de la KS (catalizado por MAT). Y un nuevo grupo malonil pasa al grupo SH de la ACP. Se inicia nuevamente el ciclo, donde se añaden dos nuevos carbonos por ciclo. De esta forma, para sintetizar el ácido palmítico de 16 carbonos, se necesitan siete ciclos y una vez finalizado, este ácido se hidroliza por una TIOSTERASA de la enzima AGS y se libera de la ACP, quedando libre en el citoplasma.
Figura 9: Biosíntesis de ácidos grasos <= 16 C. Fase 6 y final.
METABOLISMO DE LOS ÁCIDOS GRASOS DE CADENA LARGA, INSATURADOS Y POLIINSATURADOS
El palmitato formado por la acido graso sintetasa es un ácido graso saturado de 16 átomos de carbono. Para alargar este ácido graso o para introducir dobles enlaces se requieren otros sistemas enzimáticos situados en la cara citoplasmática del retículo endoplásmico liso. Cuando las membranas del retículo se fragmentan, forman unas vesículas cerradas denominadas microsomas, donde se produce elongación y por último también en las mitocondrias. El proceso que tiene lugar es idéntico al realizado por el complejo ácido graso sintetasa; el donador de los dos átomos de carbono, es la molécula de malonil-CoA y la descarboxilación da la energía para la condensación, pasando a continuación por las correspondientes reacciones de reducción, deshidratación y reducción para dar lugar a un ácido graso más largo.
Palmitato + Malonil-CoA → Estearato (C18) + CoA + CO2
La insaturación o formación de dobles enlaces (cis) se realiza a través de un complejo enzimático oxidasa (acil-[proteína-transportadora-de-acilo] desaturasa o acil-PTA desaturasa), que utiliza O2 y NADH (o NADPH) y ferrocitocromo b5. De forma esquemática la reacción que tiene lugar es:
Estearil-CoA + 2 ferrocitocromo b5 + 2NADH + O2 + 2 H+ → oleoil-CoA + 2 ferrocitoromo b5 + 2NAD+ +2 H2O
Los dos sustratos son oxidados, estearil y NADH y el aceptor de electrones reducido es el oxígeno. Usa hierro como cofactor[16]Fulco, A. J.; Bloch, K. (1964-04). «COFACTOR REQUIREMENTS FOR THE FORMATION OF DELTA-9-UNSATURATED FATTY ACIDS IN MYCOBACTERIUM PHLEI». The Journal of Biological Chemistry 239: 993-997.. Uno de los elementos del complejo enzimático es un citocromo denominado P-450 que es capaz de utilizar directamente el oxígeno como sustrato de la óxido-reducción.
Figura 10: Biosíntesis de los ácidos grasos de cadena larga y de los insaturados.
Dentro del organismo, los AGEs se pueden convertir en otros AGPIs de cadena más larga (AGPIs–CL) con más insaturaciones pero los mamíferos carecen de enzimas para introducir dobles enlaces más allá del carbono 9, y por lo tanto, ácidos grasos poliinsaturados de cadena larga (AGPIs-CL) como el ácido linoleico (AL) (C18:2 Δ 9,12) y el ácido alfa linolénico (ALA) (C18:3 Δ 9,12,15) importantes para la producción de ácidos eicosanoides y sus derivados, son catalogados como ácidos grasos esenciales y deben ser incorporados en la dieta, ya que son precursores de las familias n–6 y n–3 respectivamente, también conocidos como omega–6 y omega–3. Estas dos familias se diferencian por la posición del primer doble enlace, contando a partir del extremo metilo de la molécula del ácido graso[17]Sprecher H. Long chain fatty acid metabolism. In: Polyunsaturated fatty acids in human nutrition. Braceo U, Deckelbaum RJ (ed). New York: Raven Press; 1992, p. 13–23.. Además los AGPI n-3 son componentes fundamentales de los fosfolípidos de las membranas celulares. La biosíntesis de AGPIs–CL se lleva a cabo en los microsomas del retículo endoplásmico de los hepatocitos.
El primer exponente de los ácidos grasos ω-6 es el ácido linoleico (C18:2), el cual vía desaturasas y elongasas se puede transformar en el ácido araquidónico (AA) (C20:4). El ácido araquidónico (AA) es precursor de los prostanoides (prostaglandinas y tromboxanos) de la serie 2 y de los leucotrienos de la serie 4. Posteriormente el AA se puede transformar en el ácido docosapentaenoico (DPA)(C22:5), por la participación de elongasas y desaturasas (Ver figura).
En el hombre los isómeros del ácido linoleico conjugado aparecen como componentes minoritarios de la fracción lipídica, fundamentalmente en la carne de ovino y bovino, así como en la leche procedente de estos animales, y pueden representar en estos productos el 0,65% de los lípidos totales. Si bien este ácido se encuentra mayoritariamente en alimentos de origen animal, también puede encontrarse, aunque en proporciones muy inferiores, en aceites vegetales[18]La carne de res contiene entre 2,9 y 4,3 mg de ácido linoleico conjugado por gramo de grasa. En los quesos, el contenido oscila entre 2,9 y 7,1 mg por gramo de grasa. La leche de vaca contiene 5,5 mg de ácido linoleico conjugado por gramo de grasa, aunque esta cifra puede modificarse por diversos factores: localización geográfica, estacionalidad, alimentación del animal, etc., tales factores también condicionan la cantidad de ácido linoleico conjugado presente … Continúe leyendo. Se esterifica como un componente de los fosfolípidos de las membranas o se halla en las uniones ésteres de otros lípidos complejos. Para ser liberado debe estar no esterificado y para ello debe sufrir escisión hidrolítica. El ácido araquidónico se libera de los fosfolípidos de la membrana por la acción de fosfolipasas, que son enzimas lisosomales: la Fosfolipasa A2 y/o la Fosfolipasa C. Si interviene la fosfolipasa A2, que es calcio dependiente, aumenta el calcio intracelular, se activa la calmodulina, pudiendo convertirse el ácido araquidónico en distintos eicosanoides como las prostaglandinas, leucotrienos, lipoxinas o lipoxenos, o puede ser reacilado por la lisofosfatídico acetiltransferasa que lo reincorpora en los fosfolípidos. La importancia de estos procesos depende de cada tejido, por ejemplo los macrófagos reacilan 15 veces más en lugar de formar PGs o LTs.
Figura: Metabolismo de los ácidos grasos esenciales.
La cicloxigensa o prostaglandinsintetasa[19]A, García Meijide, Juan; J, Gómez-Reino Carnota, Juan. «Fisiopatología de la ciclooxigenasa-1 y ciclooxigenasa-2». Revista Española de Reumatología. ISSN 0304-4815. y la 5-lipoxigenasa son enzimas microsomales que catalizan la inserción de O2 en varias posiciones en el ácido araquidónico libre. Si el ácido araquidónico es sustrato de la cicloxigenasa se produce la cascada de prostaglandinas. Esta enzima se considera el paso limitante de la mayor biosíntesis de prostaglandinas que se produce en respuesta a estímulos físicos, químicos, hormonales y neurohormonales. Sin embargo se han descubierto dos isoformas de la enzima ciclooxigenasa: La cicloxigenasa 1 (COX1) y la cicloxigenasa 2 (COX2). La COX1 es una enzima constitutiva y está presente en la mayoría de las células del organismo en cambio la COX2 no está normalmente presente, es una enzima inducida por citokinas, factores de crecimiento, factores séricos. Se piensa que la COX 1 es la enzima “constitutiva”, sería la responsable de las funciones basales dependientes de prostanoides y la COX2 es la enzima “inducida”, por procesos inflamatorios y puede ser inhibida por los glucocorticoides.
Si sobre el ácido araquidónico actúa la enzima 5-lipoxigenasa (5-LO) se forma el ácido 5-hidroxiperoxieicosatetraenoico (5-HPETE), si sobre éste actúa la 5-LO se produce el leucotrieno 4, potente quimiotáctico y proinflamatorio, componente de la sustancia de reacción lenta en la anafilaxia o SRS-A. Si después de la acción de la 5-lipoxigenasa, actúa secuencialmente nuevamente la 5-lipoxigenasa se formarán las lipoxinas A y B, que también son sustancias proinflamatorias, capaces de aumentar la liberación de anión superóxido y producir la desgranulación de neutrófilos con liberación de enzimas lisosomales.
El primer exponente de los ácidos grasos omega-3 es el ácido alfa-linolénico (C18:3) el cual vía desaturasas y elongasas se puede transformar en el ácido eicosapentaenoico (C20:5, AEP) y posteriormente en el ácido docosahexaenoico (C22:6, DHA). El ácido eicosapentaenoico (AEP)(EPA), precursor de los prostanoides de la serie 3 y leucotrienos de la serie 5 (LTB5, LTC5, LTD5, LTE5) todos antiinflamatorios.[20]Simopoulos AP. Omega–3 fatty acids in health and disease and in growth and development. Am J Clin Nutr 1991; 54: 438–63. y el ácido decosahexaenoico (DHA) de origen marino, fundamental para la formación y funcionalidad del sistema nervioso, especialmente para el cerebro y la retina de los humanos[21]Valenzuela B, Rodrigo, Morales P, Jessica, Sanhueza C, Julio, & Valenzuela B, Alfonso. (2013). Ácido docosahexaenoico (DHA), un ácido graso esencial a nivel cerebral. Revista chilena de nutrición, 40(4), 383-390.. La misma vía metabólica usa el ALA para producir DHA y AEP, que son los principales productos de la familia n-3. Las enzimas que realizan las desaturaciones son la Δ6D y la Δ5D desaturasas. La primera desaturación es efectuada por la Δ6D y es el paso limitante en la síntesis de AGPIs–CL[22]De Antueno RJ, Knickle LC, Smith H, Elliot M, Allen SJ, Nwaka S, Winther MD. Activity of human D5 and D6 desaturases on multiple n–3 and n–6 polyunsaturated fatty acids. FEBS Letters 2001; 509: 77–80.. El AL y el ALA compiten por las mismas enzimas Δ5D y Δ6D desaturasas y se considera que esta última también es importante en la síntesis de DHA n–3[23]D‘Andrea S, Guillou H, Jan S, Catheline D, Thibault J, Bouriel M, Rioux V, Legrand P. The same rat D6–desaturase not only acts on 18–but also on 24–carbon fatty acids in very–long–chain polyunsaturated fatty acid biosynthesis. Biochem J 2002; 364: 49–55.. Esta competencia explica por qué el consumo elevado de ácido linoleico reduce el nivel de DHA n–3.
METABOLISMO DE LOS TRIACILGLICÉRIDOS
La biosíntesis de los triacilglicéridos se realiza en el retículo endoplásmico de casi todas la células, pero con mayor proporción en células parenquimatosas del hígado, hepatocitos, donde se sintetizan pero no se almacenan, secretadas a la circulación junto con las VLDL. También en adipocitos del tejido adiposo, donde se se almacenan; tejido muscular para su consumo e igualmente el tejido cardiaco.

Figura 11: Biosíntesis de los TAG.
REGULACIÓN DE LA LIPOGÉNESIS
La lipogénesis de novo es una vía metabólica compleja y muy regulada. Una serie de factores de transcripción tales como el receptor X hepático (LXR)[24]Los receptores X hepáticos (LXRs) son factores de transcripción dependientes de ligando que regulan la expresión de genes que juegan un papel crucial en el metabolismo del colesterol y otros lípidos, y en la regulación de la actividad de los macrófagos., la proteína 1c de unión al elemento regulador de esteroles (SREBP-1c)(sterol regulatory element-binding protein 1), y la proteína de unión al elemento de respuesta a carbohidratos (ChREBP)(Carbohydrate-responsive element-binding protein), ejercen un importante control sobre la síntesis de novo de los ácidos grasos. Los LXR son miembros de la superfamilia de receptores nucleares que heterodimerizan con el receptor X del retinoide (RXR). Los oxisteroles[25]Los oxisteroles, productos de oxidación del colesterol, se forman cuando las materias primas o los productos terminados que contienen colesterol son sometidos a tratamientos térmicos, a agentes oxidantes, o a otras condiciones físicas y/o químicas que facilitan la oxidación del colesterol. son los ligandos endógenos para la activación de los LXR. Los LXR responden al tratamiento con ácidos grasos, y en su forma activa regulan la expresión de genes importantes implicados en el metabolismo del colesterol y en la síntesis de ácidos grasos. La insulina aumenta la actividad transcripcional del PPARγ, un receptor nuclear que contribuye a la lipogénesis induciendo la expresión de genes específicos de adipocitos, adipsina y adiponectina. PPAR-γ interviene también en la diferenciación de los adipocitos.
La regulación del equilibrio de nutrientes por el hígado es importante para asegurar el control metabólico total del organismo. La expresión hepática de genes implicados en el metabolismo de los lípidos está estrechamente regulada por la glucosa y la insulina. En respuesta a los carbohidratos de la dieta el hígado convierte el exceso de glucosa en grasa para su almacenamiento mediante la lipogénesis de novo. Los LXR, anteriormente citados, inducen la transcripción de enzimas lipogénicas tales como: FAS, SCD1 (Stearoyl-CoA desaturase) y ACC, por ellos mismos o en concierto con SREBP1c y/o ChREBP.
Figura: Regulación de la lipogénesis.
TRANSPORTE PLASMÁTICO DE LOS LÍPIDOS
Figura 12: Transporte plasmático de los lípidos.
Los Iípidos de la dieta se empaquetan en quilomicrones; la mayor parte de su contenido en triacilgliceroles es liberado por la lipoproteína lipasa en los tejidos adiposo y muscular durante el transporte a través de los capilares. Los quilomicrones residuales (contienen principalmente proteína y colesterol) son captados por el hígado.
Los Iípidos endógenos y el colesterol del hígado se envían al tejido adiposo y muscular con la VLDL.
densidad), que transfiere el colesterol a los tejidos o vuelve al hígado.
LIPOPROTEÍNAS
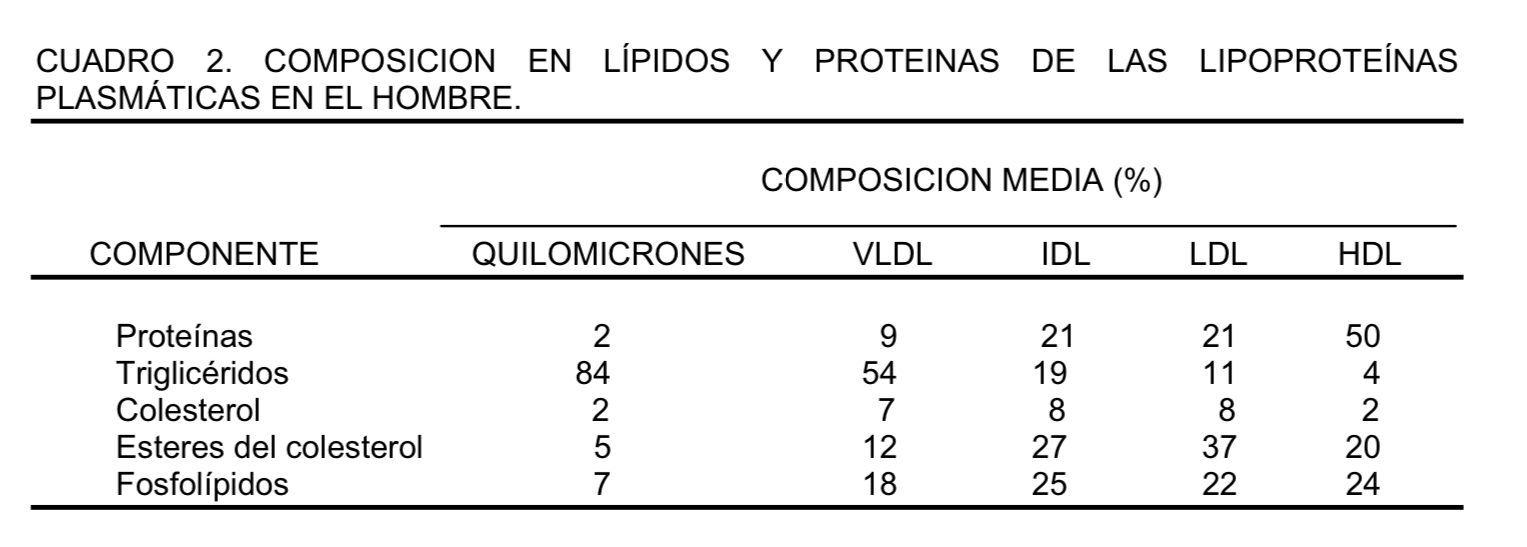
Las lipoproteínas son estructuras esféricas hidrófilas que poseen proteínas en su superficie (apoproteínas o apolipoproteínas) capaces de actuar como cofactores y ligandos para enzimas encargadas del procesamiento de los lípidos. Todos los lípidos son hidrófobos y en su mayoría insolubles en plasma, por lo que requieren ser transportados dentro de las lipoproteínas. Las lipoproteínas se clasifican en función de su tamaño y su densidad (se definen de acuerdo con la relación entre lípidos y proteínas) en VLDL (very low density lipoproteins), IDL (intermediate density lipoproteins), LDL (low density lipoproteins), liporpoteína A (Lp(a)) y HDL (high density lipoproteins), además de los QM (quilomicrones).Tabla 1 y 2 y Figura 15.
Realizan tres funciones principales:
a)Transportar las grasas de la dieta desde la mucosa intestinal, donde son absorbidas, hacia los tejidos del organismo animal; esta función la desempeñan los quilomicrones y los residuos de quilomicrones.
b) Transportar los triglicéridos desde el hígado hacia el resto de los tejidos del cuerpo, para almacenarse o ser oxidados para obtener energía. Las responsables de esta acción son las lipoproteínas VLDL. Una vez que las VLDL liberan los triglicéridos en los tejidos, los restantes constituyentes son devueltos al hígado en la forma de IDL y también como LDL.

Figura 13: Lipoproteínas.
c) Actuar como mediador en el transporte inverso del colesterol; esta tarea recae en las HDL y en las LDL, que devuelven al hígado el exceso de colesterol formado en los tejidos extrahepáticos. El cuadro 1, muestra el origen de cada una de las lipoproteínas. La densidad de estas lipoproteínas aumenta a medida que la proporción de proteínas en el complejo aumenta y a medida que los lípidos disminuyen. Los ácidos grasos libres (AGL), se transportan formando complejo con la albúmina.
METABOLISMO DE LOS QUILOMICRONES
Son lipoproteínas que se fabrican en el intestino, utilizando los lípidos de la dieta. De todos ellos, el colesterol es el más importante y procede de varias vías: El ingerido con los alimentos; el que se secreta con las bilis y el que se sintetiza "de novo" en el enterocito. Tanto el colesterol dietético como el que acompaña a la secreción biliar, requiere para su absorción de la participación de las sales biliares conjugadas (por un lado emulsionan las grasas para incrementar la superficie de contacto entre los lípidos y las enzimas encargadas de hidrolizarlos y por el otro, forman micelas simples para transportar los productos de la hidrólisis enzimática, tal como el colesterol libre, los monoacilgliceroles, ácidos grasos no esterificados, etc., hasta las microvellocidades intestinales donde son posteriormente absorbidos "). Por otro lado, las sales biliares se absorben a nivel del íleon y llegan al hígado por la vena porta, para posteriormente ser secretadas al tracto digestivo, formándose de esta manera lo que se conoce como "circulación enterohepática de las sales biliares".(Figura 14)
Figura 14: Metabolismo de los quilomicrones.
El ensamble del pre-quilomicrón consiste en un mecanismo concertado que ocurre en la luz del retículo endoplásmico liso. El primer paso de este proceso es la síntesis del quilomicrón primordial, una partícula pequeña y densa la cual está compuesta por apo B-48, fosfolípidos y muy baja cantidad de colesterol y triglicéridos. La apo B-48 es sintetizada en las membranas del retículo endoplásmico y a medida que es traducida la proteína se une a la MTP, la cual actúa como facilitadora para el correcto plegamiento de la apo B-48, además de incorporar la pequeña cantidad de lípidos necesaria para que la apo B-48 recién sintetizada no sea degradada. Una vez estabilizado el quilomicrón primordial, ocurre la fusión entre éste y la partícula liviana, grande y rica en triglicéridos, la cual contiene apo A-IV como proteína asociada. De esta manera, se origina el pre-quilomicrón que es una partícula grande, rica en lípidos, en su gran mayoría triglicéridos, y que posee apo B-48 y apo A-IV en su superficie. Esta lipoproteína inmadura es exportada del retículo endoplásmico mediante la intervención del CD36 y la L-FABP hacia el aparato de Golgi, donde es incorporada a una vesícula. La formación de esta vesícula, denominada vesícula de transporte del pre-quilomicrón, es un proceso complejo en el cual intervienen diversas proteínas y es de crucial importancia ya que constituye uno de los pasos limitantes de la secreción de los quilomicrones por los enterocitos. Como último paso, luego de arribar al aparato de Golgi, el pre-quilomicrón es procesado modificando el patrón de glicosilación de la apo B-48 y la composición de lípidos. Adicionalmente, en este punto puede ocurrir la adición de apo A-I al pre-quilomicrón. Una vez concluidos estos procesos, el quilomicrón es secretado a la circulación linfática y se incorporará a la circulación sanguínea a través del conducto torácico.
Las principales apolipoproteínas que integran los quilomicrones, se observa en la Tabla 2. Esta lipoproteína se estructura principalmente con los triglicéridos que han sido re-sintetizados a nivel intestinal, los que se asocian con las apo A-I, A-II y fundamentalmente con la apo B-48 para originar los quilomicrones nacientes (o pre-quilomicrones) que por la vía linfática llegan a la circulación general donde reciben apolipoproteínas que le servirán para metabolizarse posteriormente, como son las apo C- C-II, C-III y apo E cedidos por las HDL[29]Gibbons GF. Assambly and secretion of hepatic very low density lipoprotein. Biochem. J. 1990; 268:1-13.. Los quilomicrones se dirigen principalmente al tejido adiposo y secundariamente al tejido muscular[30]En la célula muscular, los ácidos grasos será movilizados por proteínas transportadoras de ácidos Grasos (PTAG) y luego de la activación, la acil CoA grasa tiene que atravesar la membrana mitocondrial a través del sistema carnitina palmitoil-transferasa, luego de lo cual la acil CoA puede ser degradada a acetil CoA para su oxidación. donde sufren la acción hidrolítica de la lipasa lipoproteica, enzima localizada en el endotelio capilar cuya síntesis es regulada por la insulina y requiere para su actividad la presencia de la apo C-II. Los ácidos grasos uno de los productos de hidrólisis penetran en el adipocito donde servirán para sintetizar triglicéridos, para cuyo propósito es necesario que la glucosa penetre en esta célula y se degrade por la vía glicolítica para proporcionar el glicerol-3-fosfato, componente indispensable en la formación de los triglicéridos. El glicerol, otro de los productos formados por acción de la lipasa lipoproteica, no ingresa al adipocito, dirigiéndose al hígado para su posterior transformación metabólica. (Figura 14).
Los quilomicrones, a causa de la acción hidrolítica de la lipasa lipoproteica, disminuirán de tamaño y al mismo tiempo perderán paulatinamente las diversas apolipoproteínas, manteniendo entre otras a la apo E, así mismo, se desprenderán pequeñas partículas discoidales, que originarán las HDL nacientes (junto con los originados en el hígado). Al mismo tiempo participará en una reacción de intercambio con las HDL proporcionando a ésta colesterol libre, a cambio de colesterol esterificado. Esta serie de transformaciones originan una partícula de tamaño límite denominada "remanente" de quilomicrón en cuya composición se encuentra la apo E que les permitirá ser captado por receptores de apo B/E y receptores de apo E que existen en el hígado, lugar donde los remanentes son internalizados para ser catabolizados[31]Ginsberg H, Lipoprotein physiology. Endocrinology and Metabolism Clinics ofNorthAmerica (1998)27:503-519.; en este proceso la apo B-48 no es reconocida por el receptor antes citado. Es necesario considerar que estas partículas no solamente transportan al hígado el colesterol dietético, sino aquel que le ha sido proporcionado por las HDL (ver metabolismo de las HDL), contribuyendo de esta manera a su eliminación por la vía biliar. Igualmente, es necesario tener en consideración que los "remanentes" circulan durante un tiempo relativamente prolongado en el plasma, por cuyo motivo, para la determinación del perfil lipídico es necesario que el paciente guarde un ayuno de 13 horas, condición en la que normalmente no deberá encontrarse quilomicrones circulantes[32]Me Namara DJ. Effects offat modified diets on cholesterol and lipoprotein metabolism. Ann. Rev. Nutr. 1987;7:273-290..
METABOLISMO DE LAS VLDL
El HÍGADO es el principal responsable de la biosíntesis de las VLDL circulantes. Tienen un diámetro variable de 30 a 100 nm. Por ultracentrifugación, pueden separarse en el rango de densidades de 0,95 a 1,006 g/ml y en la electroforesis tienen movilidad de pre-beta o alfa-2-globulinas. La porción lipídica de estas lipoproteínas contiene 60 % de triglicéridos, 20 % de colesterol y el resto son fosfolípidos. Sus constituyentes apoproteicos son la apo B100, A-V, C-I, C-II, C-III y E. Cabe destacar que existe un solo mol de apo B100 por mol de VLDL.
La estructuración de las VLDL depende fundamentalmente de la presencia de triglicéridos, cuya disponibilidad constituye el factor que regula la secreción de la apolipoproteína B-100 componente imprescindible de las VLDL[33]Murray P, Mayer P, Granner D, Rodwell V. Bioquimica de Harper ed. El Manual Moderno S.A. de C.V. México 1997.. Sin embargo, los triglicéridos sintetizados a partir de los ácidos grasos liberados por el tejido adiposo durante la inanición, no inducen una apropiada secreción de apolipoproteína B-100, lo que supone, con el tiempo, una acumulación anormal de triglicéridos en el hígado (hígado graso). Los fosfolípidos y sobre todo el colesterol libre y el colesterol esterificado, influyen en la secreción de apo B-100[34]Vance J. Lipoprotein assembly and secretion by hepatocytes. Annu. Rev. Nutt. 1990; 10:337-356..
La formación hepática de las VLDL (figura 15) se realiza a través de una asociación secuencial de sus componentes. En primer lugar las apo B-100 se asocian a los fosfolípidos y triglicéridos originando una partícula rica en triglicéridos. Posteriormente se unen al resto de fosfolípidos y colesterol. Una fase importante del proceso lo constituye la glicosilación de las apolipoproteínas, la que se inicia en el retículo endoplásmico y culmina en el aparato de Golgi. En esta etapa juega un rol muy importante la proteína microsomal transferidora de triglicéridos (MTP), que interactúa con las apo B- para ensamblar y secretar las VLDL. Posteriormente, éstas se concentran en las vesículas secretoras y se dirigen a la membrana basal donde se fusionan y por un mecanismo de exocitosis se liberan al espacio de Disse[35]El espacio de Disse es un compartimento situado entre las células endoteliales y los hepatocitos en el que se encuentra el microentorno en el que se produce el intercambio entre la sangre y los hepatocitos., estas VLDL iniciales están constituidas básicamente por apo B-100 y cuando llegan a la circulación general ceden su colesterol libre a las HDL y captan de esta lipoproteína el colesterol esterificado y las apolipoproteínas C y E.
Figura 15: Metabolismo de las VLDL.
Las VLDL se catabolizan preferencialmente en el tejido muscular, donde se encuentra la lipasa lipoproteica, enzima que también está presente en el endotelio capilar del tejido adiposo, glándula mamaria y otros. Ésta se activa por la apo C-11 e hidroliza a los triglicéridos, liberando ácidos grasos no esterificados y glicerol, de una manera similar al proceso metabólico que ocurre en los quilomicrones[36]Brewer HB. et al. Apolipoproteins and lipoproteins in human plasma: An overvew. Clin. Chem. 1988; 34:134.[37]Palacios E, Osada J. Función del hígado en el metabolismo de las lipoproteínas. En Hepatología Ed. María Cascales y Juan Rod6s. Madrid 1990, pag. 43-67.. La actividad de la lipasa lipoproteica depende de la relación de las apo C-III/C-II, que se encuentran en la superficie de las VLDL, cuando esta relación se incremento disminuye el catabolismo de esta lipoproteína. Como consecuencia de la acción hidrolítica de esta enzima las VLDL disminuyen de tamaño, de una manera similar a lo ocurrido con los quilomicrones, originándose las lipoproteínas (lDL), partículas que pueden ser captadas por los receptores de apo B/E o apo E que se encuentran en el hígado para luego ser internalizadas, o en su defecto pueden convertirse en LDL, para cuyo propósito es necesaria la participación de la lipasa hepática[38]Ginsberg H, Lipoprotein physiology. Endocrinology and Metabolism Clinics ofNorthAmerica (1998)27:503-519..
Después de una ingesta alimenticia, la liberación de insulina produce incremento de lipasa lipoproteica, mientras que disminuye la actividad de la lipasa sensible a la acción hormonal del adipocito. En cambio, en la etapa post-absortiva, disminuyen los niveles de insulina y aumentan los de glucagón, hormona que activa la adenil ciclasa del adipocito y posteriormente la actividad de la lipasa sensible a la acción hormonal, liberándose como consecuencia de ello ácidos grasos no esterificados que posteriormente se dirigen al hígado[39]Goldberg W. Lipoprotein lipase and lipolysis: Central roles in lipoprotein metabolism and atherosclerosis. J. Lipid. Res. 1996; 37:693-707..
Bajos niveles de insulina disminuyen la liberación de lipasa lipoproteica en el tejido adiposo y tejido muscular por lo que disminuye el catabolismo de las VLDL y aumentando así su concentración plasmática (hipertrigliceridemia).
Con dietas muy alta en carbohidratos simples, en pacientes diabéticos no controlados, en obesos y pacientes con hipertrigliceridemia familiar, se observa la secreción de una VLDL- rica en triglicéridos. Éstas son retiradas del plasma sin previa conversión en LDL. En este proceso intervienen de forma determinante la apo E y la proteína transferidora de ésteres de colesterol (PTCE), que transfiere triglicéridos a la HDL o LDL y ésteres de colesterol[40]Ginsberg H, Lipoprotein physiology. Endocrinology and Metabolism Clinics ofNorthAmerica (1998)27:503-519..
La VLDL tiene la función de transportar los triglicéridos de síntesis endógena, que son secretados a la circulación, impidiendo así la esteatosis hepática, además de redistribuir ácidos grasos a diferentes tejidos que los requieran.
METABOLISMO DE LAS IDL
Son el producto del catabolismo parcial de las VLDL. Estas lipoproteínas son más pequeñas que sus precursoras (25 a 30 nm), tienen una densidad comprendida entre 1,006 y 1,019 g/ml y su movilidad electroforética coincide con las beta globulinas. Las IDL tienen aproximadamente igual proporción de colesterol y triglicéridos. Su contenido apoproteico consiste en apo B100 y E.
Por cada molécula de VLDL que se degrada, se produce una de IDL. Existe una transferencia total de la apo B100 de la VLDL a la IDL, mientras que se van perdiendo las apoproteínas C y en menor grado la E, a la vez que se hidrolizan los triglicéridos por acción enzimática. En estado postprandial aumenta progresivamente la concentración de la IDL en el plasma, alcanzando su pico máximo a las seis horas después de la ingesta.
La IDL continúa perdiendo sus triglicéridos por acción enzimática y su apo E hasta convertirse finalmente en LDL.
METABOLISMO DE LAS LDL
Las LDL se forman a partir de la degradación de la IDL en el plasma. Tienen aproximadamente 20 nm, muy rica en colesterol esterificado, con un contenido apoproteico exclusivo de apo B100 proveniente de la IDL que es su precursora. Estas lipoproteínas flotan en un rango de densidades de 1,019 a 1,063 g/ml y poseen una movilidad electroforética de beta globulinas.
Las LDL distribuyen colesterol a los tejidos que lo requieren, para la reposición de sus componentes de membranas celulares o para la síntesis de hormonas esteroideas y, en condiciones normales, conducen parte del exceso de colesterol de regreso al hígado. Cabe destacar la participación de esta lipoproteína en la regulación de la biosíntesis del colesterol a través de su unión a receptores específicos, como se verá más adelante.
Estas lipoproteínas transportan el mayor porcentaje de colesterol en el organismo y existen varios tipos que difieren por su contenido en lípidos y proteínas, constituyendo su elevada presencia en sangre un factor de riesgo para la aterosclerosis. Gracias a la presencia de la apo B- 100 la LDL, es captada por órganos como el HÍGADO que posee receptores de apo B/E, así como, por el intestino y los órganos que sintetizan hormonas esteroides y sexuales (figura 4). Existe también una captación de LDL que no está mediada por receptores, y finalmente, las células macrófagas de Küpffer que poseen receptores que reconocen LDL, modificadas[41]Brewer HB. et al. Apolipoproteins and lipoproteins in human plasma: An overvew. Clin. Chem. 1988; 34:134.. En el endotelio vascular, los monocitos y macrófagos pueden captar, mediante receptores no saturables, a las LDL oxidadas. Estos receptores al no estar sometidos a mecanismos de regulación como los receptores apo B/E pueden captar las LDL sin limitación alguna. Esta interacción conduce a la formación de las "células espumosas"(ver figura)  como un evento previo a la formación de la estría grasa[42]Kottke B, Lipid markers for atherosclerosis. Am. J. Cardiol. 1986; 57: llc-17c. Las LDL oxidadas también promueven la secreción de citokinas por las células endoteliales y deprime la liberación de óxido nítrico. La interacción de la apolipoproteína (a) con la apo B100 de las LDL forma la lipoproteína (a)[43]Scanu AM, Lawn RM, Berg K. Lipoprotein (a). Ann. Int. Med. 199 1; 115:209-218.[44]Scanu, AM El papel de la lipoproteína (a) en la patogénesis de la enfermedad cardiovascular aterosclerótica y su utilidad como predictor de eventos de enfermedad coronaria. Curr Cardiol Rep 3 , 385–390 (2001). , partícula que tiene la propiedad de inhibir el factor beta transformador del crecimiento (TGF-B) que por su papel inhibidor de la proliferación muscular lisa, ocasiona una hipertrofia[45]Rohein PS. Atherosclerosis and lipoprotein metabolism: Role ofreverse cholesterol transport. Am. J. Cardiol. 1986;57: 3c-1 0c. característica de la placa ateromatosa.
como un evento previo a la formación de la estría grasa[42]Kottke B, Lipid markers for atherosclerosis. Am. J. Cardiol. 1986; 57: llc-17c. Las LDL oxidadas también promueven la secreción de citokinas por las células endoteliales y deprime la liberación de óxido nítrico. La interacción de la apolipoproteína (a) con la apo B100 de las LDL forma la lipoproteína (a)[43]Scanu AM, Lawn RM, Berg K. Lipoprotein (a). Ann. Int. Med. 199 1; 115:209-218.[44]Scanu, AM El papel de la lipoproteína (a) en la patogénesis de la enfermedad cardiovascular aterosclerótica y su utilidad como predictor de eventos de enfermedad coronaria. Curr Cardiol Rep 3 , 385–390 (2001). , partícula que tiene la propiedad de inhibir el factor beta transformador del crecimiento (TGF-B) que por su papel inhibidor de la proliferación muscular lisa, ocasiona una hipertrofia[45]Rohein PS. Atherosclerosis and lipoprotein metabolism: Role ofreverse cholesterol transport. Am. J. Cardiol. 1986;57: 3c-1 0c. característica de la placa ateromatosa.
Figura 16: Metabolismo de las LDL.
Los receptores de apo B/E[46]La incapacidad en la síntesis de receptores de apo B/E conduce a una severa hipercolesterolemia, que provoca muerte precoz por infarto de miocardio., que principalmente se encuentran en el hígado (figura 16), están dispuestos en depresiones de la membrana celular denominados "hoyos revestidos" recubiertos con una proteína denominada clatrina. Cuando interacciona la LDL con el receptor se estructura una vesícula con la formación posterior de un endosoma que se fusiona con los lisosomas, cuyas enzimas hidrolíticas degradan la apo B- 100 y a los ésteres de colesterol. El colesterol libre formado puede ser utilizado para integrarse a las membranas celulares, activar a la acil CoA colesterol acil transferasa enzima encargada de esterificar el colesterol a fin de que permanezca almacenado, limitar la síntesis de colesterol para cuyo propósito inhibe a la beta-hidroxi beta-metil glutaril CoA reductasa, enzima reguladora de la mencionada síntesis, o inhibir la síntesis del receptor de apo B/E, todas estas reacciones permiten regular el contenido del colesterol intracelular y por extensión el colesterol circulante.
Figura 17: Metabolismo hepático de las LDL.
La glucosa normalmente puede reaccionar sin intervención de enzimas con las proteínas, formando compuestos covalentes denominados "productos de Amadori"[47] Productos tempranos e intermedios del proceso de glucosilación proteínica., los que a través de reacciones posteriores originan los "productos finales de glicosilación avanzada" (AGE). Este proceso se da de forma más intensa en la diabetes mellitus acumulándose los AGE en el tejido conectivo de las arterias, de tal manera que cuando las LDL se depositan en la pared arterial se impide su difusión promoviéndose la formación de AGE-LDL, partícula que es reconocida y captada por los macrófagos, lo que promueve la formación de la placa ateromatosa[48]Cerami A, Vlassara H, y Brownlee M. Protein glycosylation and the pathogenesis of atherosclerosis. Metabolism 1985; 34:37-44..
METABOLISMO DE LA LIPOPROTEÍNA (A)
La Lp (a) es una lipoproteína esférica, rica en ésteres de colesterol y fosfolípidos, que se asemeja en su composición a la LDL. También contiene una glicoproteína específica, la apolipoproteína (a), que está unida a la apo B100 por un puente disulfuro[49]Koschinsky ML, Marcovina SM. Lipoprotein (a): structural implications for pathophysiology. Int J Clin Lab Res 1997;27(1):14-23.. Al igual que el LDL es una lipoproteína rica en colesterol y puede bloquear las arterias (aumentar la placa de ateroma). La apolipoproteína (a) se comporta como un factor de coagulación.
La composición de aminoácidos de la apo (a) es notablemente diferente a la de la apo B100. El alto contenido de prolina, serina y treonina en la apo (a) sugiere la aparición frecuente del giro b. Además, la serina y la treonina proporcionan abundantes sitios de glicosilación[50]Alba Zayas, Lázaro E., Pereira Roca, Giovanna, & Aguilar Betancourt, Arístides. (2003). Lipoproteína (a): estructura, metabolismo, genética y mecanismos patogénicos. Revista Cubana de Investigaciones Biomédicas, 22(1).
La proporción de carbohidratos en la apo(a) es de casi el 40% mientras que en la apo B100 no llega al 10%. De este porcentaje, 26 % es de galactosa, 9 % de manosa, 16 % de galactosamina, 12 % de glucosamina y 37 % de ácido siálico[51]Morrisett JD, Gaubatz JW, Knapp RD, Guevara JG. Structural porperties of apo (a): a major apoprotein of human lipoprotein (a), En: Scanu AM, ed. Lipoprotein (a). Nueva York: Academic Press, 1990:53-60.
Una de las características más llamativas de la apo (a) es su sorprendente homología estructural con el plasminógeno, 80 % aproximadamente.
Respecto a su metabolismo, se ha propuesto que el hígado es el sitio principal de síntesis de la apo (a), pero el esamblaje no se conoce[52]Utermann G. The mysteries of lipoprotein (a). Science 1989;246:904-10.. Un sitio posible para el ensamblaje de la Lp (a) sería el mismo hepatocito. El requerimiento de la formación de un enlace disulfuro entre la apo (a) y la apo B100 es un fuerte argumento a favor del ensamblaje intracelular de la lipoproteína (a) y sugiere que la unión podría ser catalizada por tiolasas específicas localizadas en el lumen del retículo endoplasmático liso.
Se ha propuesto un modelo de ensamblaje de la Lp (a), el cual consta de 2 pasos. Inicialmente, la apo (a) se une a la LDL mediante la interacción de un dominio kringle 4 con un residuo de lisina de la apo B100 y luego se produce la formación del puente disulfuro[53]Frank S, Djurovic S, Kostner GM. The assembly of lipoprotein(a). Eur J Clin Invest 1996;26:109-14..
Su catabolismo no está aún definido. Estudios in vitro indican que la Lp (a) puede unirse al receptor de LDL, aunque con menor afinidad que la lipoproteína de baja densidad. La Kd estimada para la Lp (a) es 9,5 nM, mientras que el valor de esta constante para la LDL es 7,8 nM[54]Floren CH, Albers JJ, Bierman EL. Uptake of Lp (a) by cultured fibroblasts. Biochem Biophys Res Commun 1995;102:636-9.. Otros autores consideran que la lipoproteína (a) es incorporada preferentemente mediante la vía del receptor scavenger[55]Mbewu AD, Durrington PN. Lipoprotein (a): structure, properties and possible involvement in thrombogenesis and atherogenesis. Atherosclerosis 1990;85:1-14..
La Lp(a) es un factor de riesgo independiente para las enfermedades cardiovasculares. El nivel de Lp(a) que se encuentra en la sangre de una persona está determinado genéticamente. Esto significa que a diferencia de otros factores de riesgo cardíacos, la Lp(a) no se puede modificar por la dieta o el ejercicio. Su nivel de Lp(a) es el mismo a los 5 años que a los 45 años. La única excepción es que su nivel puede aumentar en la menopausia y en ciertas enfermedades, como la enfermedad renal crónica.
Actualmente se considera que un nivel >50 mg/dL o >125 nmol/L debe considerarse elevado. Hay que tener en cuenta que la Lp(a) se puede medir en mg/dL y nmol/L por lo que será importante mirar las unidades de medida para saber si su nivel es elevado.
METABOLISMO DE LAS HDL
Las lipoproteínas de alta densidad (HDL) son partículas muy heterogéneas, resultado de un continuo proceso de remodelación plasmática que permite llevar el colesterol excedente de las células periféricas hacia el hígado para su excreción. Se caracterizan por ser las más pequeñas y cierta heterogeneidad en función de la clase y proporción de los lípidos que la integran, cuyo porcentaje en relación con las apolipoproteínas no es tan alto como los encontrados en las VLDL, IDL y LDL.
Por ultracentrifugación, se pueden separar en el rango de densidades de 1,063 a 1,210 g/ml. Migran con movilidad de alfa-1-globulinas en la electroforesis y tienen un diámetro de 8 a 12 nm. Prácticamente, el 50 % de la partícula son apoproteínas, las principales son A-I y A-II, aunque también pueden transportar apo A-V, C-I, C-II, C-III y algunas HDL también apo E. Alrededor del 20 % es colesterol, casi el 60 % son fosfolípidos y el resto son escasos triglicéridos.
Sus principales apolipoproteínas son las apo A-I (la más abundante)[56]La apo A-I, aparte de su función estructural, es indispensable para el eflujo de colesterol de las células periféricas, la primera etapa del transporte reverso de colesterol (TRC). La apo A-I desempeña también la función de coenzima de la lecitina: colesterol acil transferasa (LCAT), enzima clave en el transporte reverso de colesterol (TRC). Se han descrito varias subclases de HDL en función de ciertas características fisicoquímicas y funcionales. … Continúe leyendo y apo-AII. (Figura 18). Estas partículas están compuestas esencialmente de fosfolípidos y apo A-I, tienen una masa molecular aparente alrededor de 60 kD y desempeñan un papel muy importante en la captación de colesterol de las células periféricas.(Figura 18).
Son muy importantes para evitar la formación de ateromas y uno de los mecanismos que utiliza es el TRC, que se define como el regreso de colesterol proveniente de las células periféricas hacia el hígado para su excreción o reciclaje.
La función más conocida de las HDL es vehiculizar el colesterol, desde los tejidos periféricos hacia el hígado, para su reciclaje o catabolismo a ácidos biliares. Este proceso de denomina transporte inverso del colesterol. Además, las HDL poseen otras propiedades ateroprotectoras, como son: a) inhibición de la oxidación de LDL, b) inhibición de la síntesis y expresión de moléculas de adhesión endoteliales, c) inhibición de la apoptosis de células endoteliales, d) capacidad antiinflamatoria, etc.
Figura 18: Estructura de la HDL.
Esta lipoproteína procede de diferentes órganos (figura 19). Del hígado (70%), intestinos (30%) o pueden resultar del catabolismo de las lipoproteínas ricas en triglicéridos (Quilomicrones y/o VLDL) en la circulación plasmática. Se secretan como partículas discoidales denominadas genéricamente HDL nacientes (también se las conoce como pre-beta HDL), que están constituidas por las apolipoproteínas A, lecitinas y en menor porcentaje colesterol y triglicéridos. En el plasma estas partículas maduran adquiriendo forma esférica
(HDL3 y HDL2).
Las HDL nacientes se dirigen a tejidos extrahepáticos donde captan el colesterol libre que se dispone en su superficie (figura 19). Existe una enzima circulante activada por la apo A-I denominada lecitina colesterol acil transferasa (LCAT), que esterifica el colesterol con un ácido graso del carbono 2 de la lecitina, la que al perder dicho ácido graso queda convertida en lisolecitina, abandonando la HDL para posteriormente esterificarse con un ácido graso no saturado. El colesterol esterificado que se ha formado, penetra en el núcleo de la partícula y a medida que se siguen produciendo las esterificaciones, se incrementa su volumen y la lipoproteína queda transformada en una partícula madura de forma esférica denominada HDL3, que es la más pequeña de las lipoproteínas circulantes. Posteriormente, ésta sigue incrementando su volumen captando apolipoproteínas en su superficie así como fosfolípidos y triglicéridos, proceso que la transforma en HDL maduras, cuyos posteriores cambios metabólicos son diferentes y más complejos que el precedente.
El nivel de la HDL2 está influenciado por variables fisiológicas como las hormonas sexuales, insulina, ejercicio físico y dieta, a diferencia de la HDL3 cuyo nivel depende directamente de la síntesis y secreción hepática o intestinal. A su vez, las HDL2 y HDL3 pueden ser subfraccionadas, destacándose la alta capacidad antiaterogénica de las partículas más pequeñas y más densas HDL3c[57]Existe otra subfracción menos densa y más rica en colesterol denominada HDL1 o HDLc o apoE-HDL, dado que es la fracción de HDL que contiene apo E. Su formación es inducida por dietas ricas en colesterol y grasas saturadas y respondería a una mayor necesidad de conducir el exceso de colesterol hacia el hígado..
Figura 19: Metabolismo de las HDL.
En los tejidos se ha encontrado un receptor B1 que está implicado en la transferencia de los ésteres de colesterol, contenidos en las HDL[58]Landschulz KT, Pathak RK, Rigotti A, et al. Regulation of scavenger receptor, class B, type 1, a high density lipoprotein receptor in liver and steroidogenic tissues of the rat. J. Clin, Invest.1996; 98:984-995..También se ha encontrado en el plasma HLDc[59]lipoproteína semejante a la LDL, que puede ser captada por el hígado, gracias a la presencia de su apo E y luego metabolizada[60]Me Namara DJ. Effects offat modified diets on cholesterol and lipoprotein metabolism. Ann. Rev. Nutr. 1987;7:273-290..
La HDL cede los ésteres de colesterol a las VLDL y a los quilomicrones con intervención de proteínas transferidoras de lípidos neutros (PTLN) y al mismo tiempo capta triglicéridos de estas lipoproteínas, posteriormente con intervención de la lipasa hepática y la lipasa lipoproteica, hidrolizan los triglicéridos y fosfolípidos quedando convertida nuevamente en HDL. El conjunto de reacciones en que el colesterol es transportado de los tejidos extrahepáticos al hígado se conoce como "transporte inverso del colesterol" y ello naturalmente tiene sus implicaciones en patologías como la aterosclerosis, en cuyo contexto un elevado nivel de HDL sérico constituiría un medio de protección, considerándosele, por tal motivo, un factor de riesgo negativo para la aterosclerosis[61]Rohein PS. Atherosclerosis and lipoprotein metabolism: Role ofreverse cholesterol transport. Am. J. Cardiol. 1986;57: 3c-1 0c.. También se ha observado que las HDL ejercen un efecto protector al ligar fuertemente a la paraoxonasa, enzima que degrada lípidos peroxidados afectando probablemente la oxidación de las LDL, proceso vinculado con la aterogénesis, ya que los LDL oxidados son atacados por los macrófagos transformándose en células espumosas que se atascan en las paredes de las arteriolas formado ateromas [62]Heinecke J y Lusis A, Paraoxonase-gene polymorphisms associated with coronary heart disease: Support for the oxidative damage hypothesis? Am. J. Hum. Genet. 1998;62:2024..
Las actividades antiaterogénicas que poseen las HDL incluyen el transporte inverso de colesterol, protección a las LDL contra la oxidación, preservación de la función del endotelio vascular, regulación de la expresión de moléculas de adhesión y de los procesos de coagulación y fibrinolíticos que participan en el proceso ateroscleroso.
CATABOLISMO DE LOS LÍPIDOS. LIPÓLISIS
La lipólisis se realiza en el hígado, en el tejido adiposo, glándulas mamarias en lactación y tejido muscular esquelético y cardíaco. Consta de varias etapas:
- HIDRÓLISIS ENZIMÁTICA:
Representa el inicio del proceso catabólico de los TAG, cuando éstos son hidrolizados por diferentes LIPASAS, según los diferentes tejidos implicados y han sido clasificadas en 8 familias, algunas con diferentes subfamilias[63]Salazar Carranza, Luz Angelica, Hinojoza Guerrero, Marilú Mercedes, Acosta Gaibor, Mónica Patricia, Escobar Torres, Alicia Filadelfia, & Scrich Vázquez, Aldo Jesús. (2020). Caracterización, clasificación y usos de las enzimas lipasas en la producción industrial. Revista Cubana de Investigaciones Biomédicas, 39(4), e620.. Entre ellas destacamos por su importante papel fisiológico la lipasa ácida lisosomal (LAL; EC 3.1.13)[64]Aslanidis C, Ries S, Fehringer P, Büchler C, Klima H, Schmitz G. Genetic and biochemical evidence that CESD and Wolman disease are distinguished by residual lysosomal acid lipase activity. Genomics. 1996; 33:85-93. ubicada en macrófagos, hepatocitos, células intestinales y de Kupffer. La lipasa endotelial, lipasa hormonosensible (tejido adiposo), lipasa lipoprotéica (músculo), lipasa salival, lipasa gástrica, etc. Estas enzimas liberan en su acción hidrolítica, dos ácidos grasos no esterificados con un grupo carboxilo libre (AGNE) y un monoacilglicerol[65]Saponaro, Chiara; Gaggini, Melania; Carli, Fabrizia; Gastaldelli, Amalia (noviembre de 2015). «The Subtle Balance between Lipolysis and Lipogenesis: A Critical Point in Metabolic Homeostasis» [El delicado balance entre la lipólisis y la liponeogénesis: un punto crítico en la homeostasis metabólica]. Nutrients (en inglés) (Multidisciplinary Digital Publishing Institute (MDPI)) 7 (11): 9453-9474. … Continúe leyendo. El monoacilglicero es procesado por la enzima monoacil glicerol lipasa (MGL) dando un AGNE y un glicerol. Mientras que en el hígado este glicerol puede ser metabolizado, en el tejido adiposo y en el músculo el glicerol no puede ser utilizado ya que carecen de la glicerol kinasa (glpF) (o está muy disminuida su actividad). Una fracción de los AGNE vuelven a ser re-esterificados con el glicerol existente, bien por:
a) Síntesis de novo a partir de la glucolisis en hígado que es el único que tiene la glicerol kinasa o en el tejido adiposo, donde el glicerol 3-fosfato se deriva de la dihidroxiacetona fosfato por la enzima deshidrogenasa glicerol-3-fosfato.
b) O de los producidos en la lipólisis, para generar nuevamente TAG[66]Stich V, Berlan M (2004) Physiological regulation of NEFA availability: lipolysis pathway. Proc Nutr Soc 63:369-374.. El resto junto con el glicerol no utilizado, son liberados de la célula al espacio intersticial y luego a la circulación, donde viajan unidos de una forma no covalente a una proteína portadora, la albúmina sérica. El glicerol sérico puede ser utilizado como marcador de la lipólisis.
1.1. ACCIÓN DE LAS LIPASAS:
Las lipasas son responsables de la hidrólisis de los TAG. En el tejido adiposo es la lipasa hormono-sensible la responsable, mientras que en el músculo esquelético y cardíaco se han encontrado tres lipasas: ácida, neutra y alcalina. La alcalina es la responsable de romper el TAG plasmático mientras que la lipasa neutra es hormono-sensible y rompe los TAG intramusculares próximos a las mitocondrias (12 mmol/kg de peso). Esta última enzima depende de la actividad β2-adrenérgica. En el hígado se encuentra la lipasa hepática que muestra una alta especificidad y afinidad por determinados sustratos como el IDL, HDL y LDL.
Las lipasas hormono-sensibles (HLS) (característica del tejido adiposo, entre otros) determinan el paso limitante de la lipólisis, ya que su acción está regulada por el sistema nervioso simpático (SNS) y por las hormonas adrenalina, cortisol, HT, HG, glucagón e insulina. El SNS tiene doble papel según el receptor estimulado. La vía α-adrenérgica inhibe la lipólisis y igual que la insulina, mientras que la vía β-adrenérgica la activa igual que la adrenalina, cortisol, HT, HG y el glucagón.
2. ACTIVACIÓN DE LOS AGNE:
La activación se realiza en dos etapas en el citosol, en las que los AGNE son convertidos a tioésteres de Coenzima A, mediante la enzima acilCoA sintetasa que se encuentra en la membrana externa mitocondrial. En esta reacción se consume ATP.
3. ENTRADA A LA MITOCONDRIA:(Figura 20)
Una vez activados, los AGNE de cadena corta son transportados directamente a la matriz mitocondrial, sin embargo los de cadena larga necesitan un mecanismo de transporte mediante la conjugación con la CARNITINA. La enzima carnitil palmitoiltransferasa I (CPTI) (también carnitina acetil transferasa I) de la membrana mitocondrial externa elimina el CoA del acilCoA y lo une a la carnitina situada en el espacio transmembranoso mitocondrial, formando acilcarnitina y el CoA queda libre en el citosol. Una translocasa de la membrana interna mitocondrial introduce en la matriz mitocondrial la acilcarnitina que mediante la carnitil palmitoiltransferasa II (CPTII) de la membrana interna de la mitocondria une un CoA a la acetilcarnitina generando el acil CoA y liberando la carnitina que vuelve al espacio transmembranoso mitocondrial iniciando nuevamente el ciclo.
Figura 20: Mecanismo de transferencia del AGNE activado al interior mitocondrial.
4. BETA-OXIDACIÓN:(Figura 21)
Una vez el ácido graso se encuentra en la matriz mitocondrial, es sometido a un ciclo de β-oxidación (en el carbono β del acil-CoA) en cuatro etapas: oxidación, hidratación, oxidación por NAD+ y tiólisis. En cada uno de estos ciclos el ácido graso pierde dos carbonos en forma de acetil-CoA (Figura 21).
Figura 21: Beta-oxidación.
En la primera etapa de oxidación, el FAD (unido a la acil-CoA deshidrogenasa como grupo prostético) es el aceptor de electrones, electrones que pasan a la cadena de transporte.
En la hidratación de los carbonos 2 y 3, la reacción es estéreo específica y se produce el isómero L del 3-hidroxiacil-CoA.
En la tercera reacción (oxidación por NAD+) se produce NADH y también es especifica para el L-isómero del sustrato. Y en la cuarta (tiólisis) da lugar a una molécula de acetil-CoA y un acil-CoA con dos carbonos menos.
En la figura 21 se muestra el rendimiento energético de un ciclo de la β-oxidación. El rendimiento total se calcula multiplicando ese valor por el número de ciclos (éste se calcula dividiendo por dos el número total de carbonos del AGNE).Al resultado se le resta 2, que son los ATP consumidos en el paso de la activación.
LA CETOGÉNESIS:
La Cetogénesis o formación de "Cuerpos Cetónicos" (CC) (figura 22) se realiza en la mitocondria de los hepatocitos como vía catabólica alternativa para acetatos activos y en menor proporción, también en el riñón. Sucede cuando hay un índice alto de oxidación de AGNE en el hígado o hay una alta demanda de combustible oxidativo y las reservas de carbohidratos son bajas (menor de 80 gr/día). En estas circunstancias la baja concentración de insulina y el alto nivel de cortisol y glucagón son señales que activan la cetogénesis. La cetogénesis es producto de una β-oxidación incompleta de los AGNE y la cetosis representa un estado en que la producción hepática de cetonas es mayor que la utilización extrahepática de las mismas.
Figura 22: Cetogénesis.
En la cetogénesis la primera reacción es la condensación de dos moléculas de acetil-CoA (procedente de la β-oxidación), para formar acetoacetil-CoA, gracias a la acción de la enzima β-cetotiolasa. Luego la molécula de acetoacetil-CoA se condensa con otra molécula de acetil-CoA para formar β-hidroxi-β-metilglutaril-CoA (HMG-CoA), por acción de la enzima HMG-CoA sintasa. Finalmente, la HMG-CoA liasa hidroliza el HMG-CoA en una molécula de acetoacetato y una de acetil-CoA. El paso de acetoacetato a β-hidroxibutirato es realizado por la β-hidroxibutirato deshidrogenasa oxidando el NADH (consumo de ATP). Este último paso puede realizarse en ambos sentidos por la misma enzima. El equilibrio entre ambos es controlado por la proporción [NAD+]/[NADH] mitocondrial, es decir, el estado de redox. Por otro lado, el acetoacetato sufre una lenta descarboxilación espontánea, resultando acetona, que es eliminada por la orina y la respiración.
Aunque el hígado es el único que los produce, no puede usarlos con fines energéticos por ello, los CC pasan a la circulación. El valor normal de CC en plasma es menor de 0,6 mmol/L. Valores superiores dan idea de un metabolismo cetogénico y cuando se instalan en circulación dan idea de patologías relacionadas. Por encima de 1,1 – 3,0 mmol/L se corre el riesgo de cetoacidosis. Además generan reducción del pH sanguíneo y obliga a los riñones a excretarlos, generando una orina ácida y acompañada de agua y electrolitos (CETONURIA).
Las dietas cetónicas determinan cetosis nutricional que no es patológica dado que los cuerpos cetónicos se convierten en moléculas energéticas, no generando alteraciones en el pH de la sangre.
Los cuerpos cetónicos pueden ser utilizados como sustrato energético por el cerebro, el corazón y el músculo esquelético, y en pequeña medida por otros tejidos. Éstos utilizan los cuerpos cetónicos metabolizándolos hasta el acetil-CoA como se ve en la figura 23.
Figura 23: Catabolismo de los cuerpos cetónicos.
REGULACIÓN DE LA LIPÓLISIS
La regulación en la liberación de los AGNE y la lipólisis viene definida por las necesidades energéticas del cuerpo dependiendo de su situación fisiológica.

Figura 24: Regulación homeostática de la lipólisis.
La lipólisis está bajo el control nervioso y hormonal junto con la acción concertada de numerosas proteínas (Figura 24), que implican notablemente a la lipasa sensible a hormona (LSH) en el tejido adiposo. La noradrenalina y la adrenalina (catecolaminas) son las sustancias responsables de la estimulación del metabolismo de las grasas por vía de tres subtipos de receptores β adrenérgicos[67] Tavernier G, Jiménez M, Giacobino JP, Hulo N, Lafontan M, Muzzin P, Langin D (2005) Norepinephrine induces lipolysis in beta1/beta2/beta3-adrenoceptor knockout mice. Mol Pharmacol. 68:793-799.. Los eventos metabólicos siguientes a la activación de estos receptores están ligados con el incremento en los niveles de AMPc (nucleótido cíclico 3’- 5’ monofosfato de adenosina), activación de la proteína cinasa A (PKA) y la fosforilación activa tanto de la LSH como de la perilipina A, siendo la LSH la de mayor influencia en la regulación de la lipólisis estimulada por receptores adrenérgicos. Enzima que trabaja en la interfase citosol (agua)-depósito de TAG (lípidos neutros), donde solo pequeñas cantidades de sustrato están accesibles[68]Londos C, Brasaemle DL, Schultz CJ, Segrest JP, Kimmel AR (1999) Perilipins, ADRP, And Other Proteins That Associate With Intracellular Neutral Lipid Droplets In Animal Cell. Semin Cell Dev Biol 10:51-58..
Las perilipinas son específicas de los lipocitos [69]Las perilipinas, proteínas que pertenecen a una familia de fosfoproteínas, son específicas de los adipocitos y recubren la superficie de las gotas de lípidos actuando como guardianes y controlando los procesos de almacenamiento y liberación de TAG. De las tres diferentes isoformas de perilipinas, la perilipina A es la más abundante en los adipocitos. Tiene tres regiones de 20 residuos de aminoácidos con carácter hidrofóbico moderado y cinco dominios … Continúe leyendo y sus funciones es la de prevenir la lipólisis en condiciones basales (cuando el cuerpo está recién alimentado) ya que se fosforila en niveles mínimos impidiendo el acceso de las lipasas citosólicas a los TAG almacenados. Por otro lado, en la estimulación de la lipólisis por las catecolaminas se debe a que la fosforilación de perilipinas dependiente de PKA, en seis residuos de serina (sitios de consenso PKA), refleja cambios conformacionales en las perilipinas que exponen los depósitos de lípidos neutros, facilitando el desplazamiento de la LSH a las gotitas de lípido[70]Londos C, Brasaemle DL, Schultz CJ, Adler-Wailes DC, Levin DM, Kimmel AR, Rondinone CM (1999) On the control of lipolysis in adipocytes. Ann N Y Acad Sci 18:155-168..
Las proteínas citosólicas en el adipocito, llamadas proteínas que enlazan lípidos en adipocito (ALBP) son proteínas intracelulares de bajo peso molecular, que forman complejos con ácidos grasos, retinoides y otros ligandos hidrofóbicos e interactúan con la región N-terminal de la LSH, evitando la acumulación de AGNE durante la lipólisis[71]Londos C, Brasaemle DL, Schultz CJ, Adler-Wailes DC, Levin DM, Kimmel AR, Rondinone CM (1999) On the control of lipolysis in adipocytes. Ann N Y Acad Sci 18:155-168..
Además de la acción de las catecolaminas sobre la lipólisis adiposa, a través de los receptores α2,A-adrenérgicos (inhibiendo) y por los β1,2-adrenérgicos (estimulando), se ha encontrado que los péptidos natriuréticos (NP) (ANP: péptido natriurético auricular, el BNP: péptido natriurético cerebral y el CNP o factores natriuréticos del tipo C) tienen un potente estímulo sobre la lipólisis en el tejido adiposo, siendo el de mayor efecto el ANP. Los receptores para el ANP y BNP tienen actividad guanilil ciclasa (GC), el CNP no por lo que no interviene en la lipólisis. El GMPc (nucleótido cíclico 3’,5’-monofosfato de guanosina) producido, después de la activación de los receptores acoplados a GC, tiene múltiples efectores dentro de la célula, que incluye la familia de la proteína cinasa G (PKG), las fosfodiesterasas dependientes de GMPc, los canales bloqueados por GMPc y en algunos casos, la proteína cinasa A dependiente de AMPc. El GMPc activa a la PKG1 que a su vez fosforila a la LSH estimulando la lipólisis.
Otros intermediarios citosólicos del adipocito implicados en la lipólisis son la interleucina 6 (IL6) inhibe a la LSH y disminuye la lipólisis. También el óxido nítrico (NO) producido enzimáticamente por las isoformas de sintetasa de NO (NOS) II y III inhibe la oxidación de los AGNE. Inhibe de manera dosis-dependiente, el estímulo de la lipólisis por agonistas β-adrenérgicos o por la estimulación de la AC. Esto implica la disminución de los niveles de AMPc[72]Klatt P, Cacho J, Crespo MD, Herrera E, Ramos P (2000) Nitric Oxide inhibits isoproterenol-stimulated adipocyte lipolysis through oxidative inactivation of the β-agonist. Biochem J. 351:485-493..
HOMEOSTASIS DEL METABOLISMO DE LOS LÍPIDOS
El hígado juega un papel importante en la homeostasis lipídica, en especial en la síntesis de ácidos grasos y triglicéridos (TG), colesterol y en la producción de lipoproteínas plasmáticas que aseguran el transporte de lípidos endógenos y exógenos entre los órganos. Su equilibrio es regulado por mecanismos de retroalimentación entre las vías endógena y exógena. La inhibición de absorción de colesterol intestinal aumenta la actividad de la hidroximetilglutaril coenzima A reductasa (HMG-CoAR) intensificando su síntesis en el hígado. En cambio, una captación intestinal elevada de colesterol inhibe la HMGCoAR, reduce la síntesis hepática y produce una regulación negativa de los receptores de las lipoproteínas de baja densidad (LDLr), lo que reduce la captación de lipoproteínas de baja densidad (LDL). Por el contrario, cuando existe una disminución en las concentraciones de colesterol, los LDLr son regulados al alza y dan lugar a un aumento de la eliminación de partículas de LDL de la sangre.
La lipolisis es estimulada por diferentes hormonas catabólicas como el glucagón, la adrenalina, la noradrenalina, la hormona del crecimiento y el cortisol, a través de un sistema de transducción de señales. La insulina disminuye la lipolisis.
La disponibilidad de AGNE gobierna principalmente el balance entre los procesos lipogénesis/lipólisis de la mayoría de los TAG almacenados en tejido adiposo. La regulación de la liberación de AGNE y la lipólisis es moderada para responder a las necesidades energéticas del cuerpo dependiendo de la situación fisiológica dada. Si esta atenuación falla, no sólo se ve afectada la compensación energética adecuada, sino que también puede haber un exceso de AGNE liberados. En ambos casos se pueden causar disturbios metabólicos, tales como diabetes tipo 2 o el llamado síndrome metabólico X[73]Londos C, Brasaemle DL, Schultz CJ, Adler-Wailes DC, Levin DM, Kimmel AR, Rondinone CM (1999) On the control of lipolysis in adipocytes. Ann N Y Acad Sci 18:155-168..
ENLACES DEL TEMA EN LA WEB
Ceras. Wikipedia
Ácidos grasos esenciales. Elsevier
Metabolismo de las grasas durante el ejercicio.
Las grasas y aceites en la alimentación humana. Valsecia –Malgor
Lipopreoteínas de alta densidad
Tipos de lipasas
FARMACOLOGIA DE LOS EICOSANOIDES: PROSTAGLANDINAS Y PRODUCTOS RELACIONADOS. Valsecia-Malgor, pdf.
VIDEOS
PATOLOGÍAS
Enfermedades metabólicas. UNSIS
Síndrome metabólico. Clinic Mayo.
Síndrome metabólico. NHLBI-NIH.
BIBLIOGRAFÍA GENERAL
Rodríguez-Cruz, Maricela, Tovar, Armando R, del Prado, Martha, & Torres, Nimbe. (2005). Mecanismos moleculares de acción de los ácidos grasos poliinsaturados y sus beneficios en la salud. Revista de investigación clínica, 57(3), 457-472. LINK
FISIOLOGÍA / METABOLISMO / METABOLISMO DE LOS LÍPIDOS
![]()




 Se encuentra en las yemas de huevos, las habas de soja, las semillas de girasol y en las células de las semillas de las plantas. Las lecitinas de soja y girasol contienen muchos más ácidos grasos esenciales que la lecitina de colza y por tanto, son más valiosas desde un punto de vista nutricional. Las principales funciones de la lecitina son estabilizar las membranas celulares, estimular diversos procesos metabólicos, respaldar la regeneración de células hepáticas y muchas otras.
Se encuentra en las yemas de huevos, las habas de soja, las semillas de girasol y en las células de las semillas de las plantas. Las lecitinas de soja y girasol contienen muchos más ácidos grasos esenciales que la lecitina de colza y por tanto, son más valiosas desde un punto de vista nutricional. Las principales funciones de la lecitina son estabilizar las membranas celulares, estimular diversos procesos metabólicos, respaldar la regeneración de células hepáticas y muchas otras.








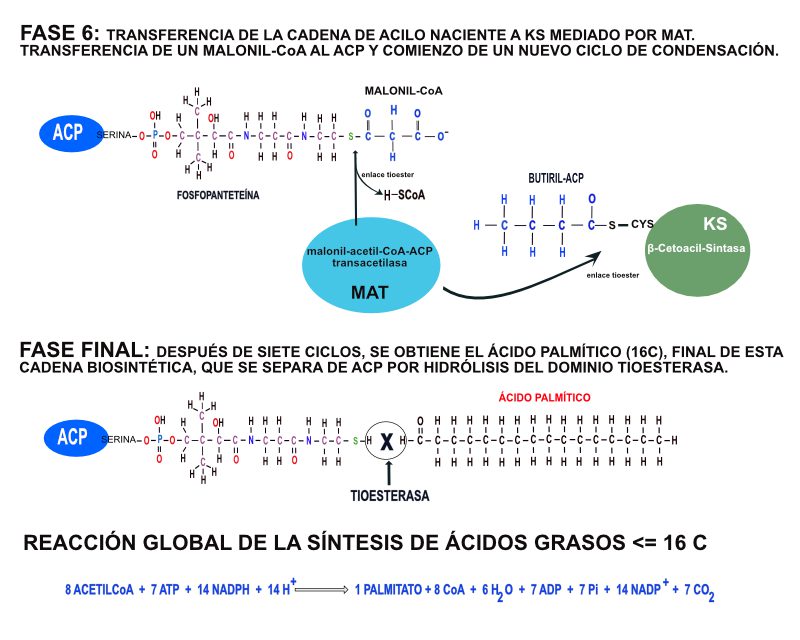















 Views Today : 674
Views Today : 674 Views This Month : 15024
Views This Month : 15024 Views This Year : 29802
Views This Year : 29802 Total views : 398949
Total views : 398949