Ingrese su ID de correo electrónico
FISIOLOGIA / SISTEMA ENDOCRINO / EJE TIROIDEO / T3/T4
LA T3/T4 (HORMONAS TIROIDEAS)(TRIYODOTIRONINA Y TIROXINA)
TABLA DE CONTENIDO
- Objetivos
- Eje tiroideo
- Aspectos morfofuncionales
folículo como unidad funciona
- Hormonas tiroideas
- Biosíntesis, almacenamiento y secreción
estructura química de las hormonas tiroideas
balance orgánico del iodo
biosíntesis
secreción
endocitosis del coloide
procesado enzimático
liberación
producción diaria y almacén extracelular - Transporte sanguíneo y metabolización
proteínas transportadoras
afinidad y capacidad
relación hormona unida/hormona libre
factores que modifican dicha relación
metabolización celular de la T 4
desiodización
enzima tipo I
factores reguladores
enzima tipo II
factores reguladores
conjugación de la T 4
deaminación de la T 4 - Acciones biológicas
mecanismo de acción
acciones
papel calorígeno
papel metabólico
papel en el crecimiento y desarrollo
en órganos y sistemas
interrelaciones con otros ejes endocrinos - Regulación del eje endocrino
factores reguladores
- Consecuencias fisiológicas de las alteraciones en la secreción
hiposecreción: mixedema y cretinismo
hipersecreción: tiroxicosis - Referencias
OBJETIVOS
- Conocer la anatomía funcional del Tiroides.
- Conocer la síntesis de las hormonas tiroideas.
- Conocer la importancia del yodo en la dieta y su metabolismo. Y las consecuencias de un déficit de yodo.
- Entender el significado fisiológico y la regulación del metabolismo de la tiroxina a triyodotironina o a triyodotironina inversa.
- Conocer las acciones de las hormonas tiroideas y entender los efectos que estas acciones ejercen de forma secundaria en otros tejidos.
- Comprender las diferencias entre las acciones fisiológicas de las hormonas tiroideas y los efectos que puede producir un exceso o un déficit de hormonas.
- Entender la respuesta fisiológica del organismo ante determinadas situaciones que producen aumentos o disminuciones de las hormonas tiroideas como el ayuno, la disminución o el aumento de temperatura, etc.
- Conocer la regulación en el eje Hipotálamo-Hipófisis-Tiroides.
- Conocer las respuestas adaptativas que se ponen en marcha en el eje Hipotálamo-Hipófisis-Tiroides ante situaciones como: fallo en la capacidad de síntesis de hormonas tiroideas, alteraciones en la yodación o déficit de yodo, alteraciones en la transformación periférica de las hormonas, etc.
- Entender las diferencias entre los aumentos y disminuciones de la función tiroidea de origen tiroideo o hipofisario.
EL EJE TIROIDEO. HORMONAS TIROIDEAS (T3/T4)
En el eje tiroideo: hipotálamo-hipófisis-tiroides, las hormonas tiroideas T3/T4 son las últimas de dicho eje. Ellas ejercen su acción final en el metabolismo energético del sujeto y adapta ciertos órganos para conseguir dicha acción. Están bajo el control de la TRH y la SST hipotalámica y de la TSH adenohipofisaria.
Figura 1: Esquema del eje tiroideo.
En 1915, Kendall[1]Kendall EC. The isolation in crystalline form of the compound which occurs in the thyroid: its clinical nature and physiological activity. JAMA 1915; 64: 2042 [2]Kendall EC, Osterberg AE. The chemical identification of thyroxin. J Biol Chem. 1919; 40: 265-334 [3]Kendall EC. Isolation of the Iodine Compound Which Occurs in the Thyroid. J Biol Chem. 1919; 39. 125-147. identificó la hormona tiroidea y la llamó tiroxina, posteriormente, en 1927 Harington y Barger [4]Harrington CR. Thyroxine III. Constitution and synthesis of thyroxine. Biochem J 1927: 21: 169 [5]Harington CR, Barger G. Chemistry of Thyroxine – Constitution and Synthesis of Thyroxine. Bioch J. 1927; 21(1): 169–183. [Texto completo] la sintetizaron químicamente y en 1952 Gross y Pitts-Rivers [6]GRoss, J. & PITT-RIVERS, R. (1952a). The identification of 3:5:3′-L-triiodothyronine in human plasma. Lancet, 262, 439-440. [7]GRoss, J. & PITT-RIVERS, R. (1952b). Physiological activity of 3:5:3′-L-triiodothyronine. Lancet, 262, 593-594. [8]GROSS, J. & PITT-RIVERS, R. (1953a). 3:5:3′-Triiodothyronine. 1. Isolation from thyroid gland and synthesis. Biochem. J. 53, 645-650 .[Texto completo] [9]GROSS, J. & PITT-RIVERS, R. (1953b). 3:5:3′-Triiodothyronine. 2. Physiological activity. Biochem. J. 53, 652-657.[Texto completo] por un lado y Roche, Michel y Lissitzsky[/fn] [10]ROCHE, J., LISSITZKY, S. & MICHEL, R. (1952a). Sur la triiodothyronine, produit intermediaire de la transformation de la diiodothyronine en thyroxine. C.R. Acad. Sci., Paris, 234,997-998. [11]ROCHE, J., LISSITZKY, S. & MICHEL, R. (1952 b). Sur la presence de triiodothyronine dans la thyroglobuline. C.R. Acad. Sci., Paris, 234, 1228-1230. [12]ROCHE, J., MICHEL, R., MICHEL, 0. & LISSITZKY, S. (1951). Deshalogenation enzymatique des acides amines iodes dans le corps thyroide et thyroxinemie. C.R. Soc. Biol., Paris, 145,288-290. por otro, identificaron una segunda hormona tiroidea, denominándola triyodotironina (T3).
HORMONAS TIROIDEAS. ASPECTOS MORFOFUNCIONALES DEL TIROIDES.
Es la primera glándula endocrina que aparece en el desarrollo embrionario (a partir de los 16 a 17 días de gestación). Origen endodérmico, formándose como apéndice en las 4ª y 5ª bolsas faríngeas, que en el hombre incluyen el cuerpo último-branquial del que derivan las células parafoliculares de origen neural, productoras de calcitonina y las glándulas paratiroides. A los 40-45 días alcanza la localización anatómica definitiva y entre la 20 y 24 semanas de gestación aparecen niveles séricos importantes de TSH y T4.

Figura 2: Glándula tiroides.
La glándula (figura 2) está formada por dos lóbulos unidos por una porción de tejido, denominado istmo tiroideo, que a veces puede dar lugar a un tercer lóbulo, denominado lóbulo piramidal. Esta glándula se encuentra entre el cartílago tiroides y la tráquea, anterior a ésta y entre los músculos esternocleidomastoideo; es fácilmente palpable. Tiene un peso medio de 25 gramos y recibe la irrigación de las arterias tiroideas superior e inferior. Esta glándula recibe una de las tasas más altas de flujo sanguíneo por gramo de tejido (4ml/gr/min).
El tejido glandular está formado por agrupaciones acinares. Cada acino está formado por una sola capa celular cuya base está en contacto con los capilares sanguíneos y los vasos linfáticos, y por su polo apical rodean a una matriz coloidal. El diámetro medio de estos acinos es de 100 a 500 µm. Las células de cada acino son policlonales lo que supone que se encuentren en cada momento acinos en diferentes estadios de respuesta a un mismo estímulo.

Figura 3: Agrupaciones acinares del tiroides.Este tejido acinar o folicular se caracteriza por presentar cambios morfológicos en función de su activación (figura 3). Si no está estimulado su morfología es de grandes folículos con abundante coloide y células acinares planas. Cuando es estimulado los folículos se reducen, las células incrementan su tamaño, haciéndose cuboides y presentando su citoplasma un incremento considerable de gotas de coloide, procedentes de la reabsorción coloidal por pinocitosis.
HORMONAS TIROIDEAS. BIOSÍNTESIS Y SECRECIÓN
La biosíntesis de estas hormonas se realiza en el tiroides y dependen del balance del iodo . (Pitt-Rivers, 1960 [13]PITT-RIVERS, ROSALIND. (1960). BIOSYNTHESIS OF THF THYROID HORMONES. Br Med Bull.1960; 16: 118-121. ). Y se puede clasificar en cuatro etapas:
– CAPTACIÓN DEL IODURO PLASMÁTICO
– OXIDACIÓN DEL IODURO
– ORGANIFICACIÓN DEL IODO
– SECRECIÓN DE LAS HORMONAS TIROIDEAS
Figura 4: Etapas en la biosíntesis de las hormonas tiroideas.
En el feto a partir de las semanas 18-20 empieza a funcionar el eje tiroideo [14]Bilezikian JP, Loeb J. (1983). The influence of hyperthyroidism and hypothyroidism on alpha and beta adrenergic receptor systems and adrenergic responsiveness. Endocr Rev 4: 378-88..
Aunque existe un biosíntesis basal de hormonas tiroideas, ésta se incrementa como consecuencia de la acción estimuladora de la TSH adenohipofisaria. La TSH interacciona con los receptores de la membrana de las células acinares tiroideas, dando lugar a un incremento intracelular de la concentración de AMPc, lo cual potencia una serie de fenómenos intracelulares. Además del AMPc hay otro mecanismo intracelular implicado: el sistema Ca 2+-GMPc, estimulado por influjos colinérgicos que determinan incrementos de la yodación de proteínas; incremento de la vía de las pentosas fosfatos y disminución del AMPc y T3/T4.
Otro mecanismo viene determinado por el yodo dietético de forma que cuando éste aumenta disminuye la producción de T3/T4 debido a que se produce una sustancia oxidada la XT que inhibe la formación de AMPc.
Figura 5: Biosíntesis de HT. Captación del I-
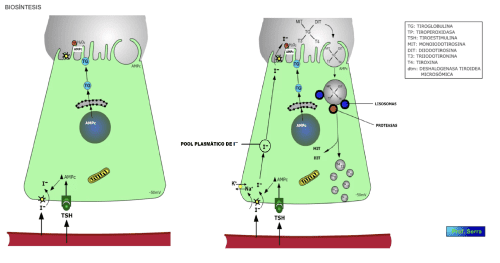
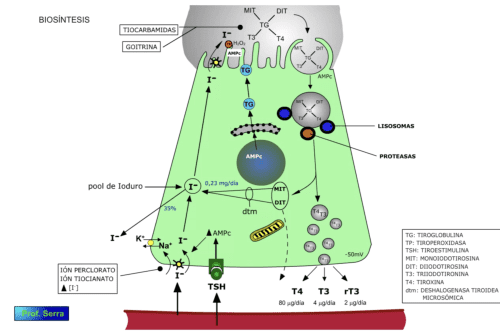
Cuando la TSH se une a su receptor en la célula acinar del tiroides (figura 5), se activa la "bomba de yodo" ("trampa de yodo") dependiente de la Na +/K+ ATPasa. Esta "bomba" (simporte de sodio e ioduro) es necesaria debido a la mayor concentración de yodo intracelular y debido al potencial de -50 mV existente en el interior celular. Como consecuencia se produce un incremento de la captación del yoduro circulante, con el consecuente incremento de la concentración intracelular de yoduro plasmático, al cual se le une parte del yoduro procedente de la degradación enzimática intracelular de las hormonas tiroideas antes de su secreción. Esta captación se inhibe cuando el aporte de yodo excede los 2 mg diarios (efecto de Wolff-Chaikoff), declinando la síntesis a valores normales; por el contrario, si se reduce el aporte de yodo se produce una activación inusual de la "bomba de yodo", incrementándose mucho la captación de yoduro, sin embargo si la disminución de yodo externo es severa no se produce hormona tiroidea. El ion perclorato y el tiocianato, entre otros, inhiben competitivamente el transporte activo de yoduro.
Figura 6: Factores que inhiben la captación de ioduro.
Oxidación del yoduro (figura 6):
El yoduro incorporado a la célula acinar se dirige hacia el polo apical, pasando a la luz coloidal. Allí es oxidado por una enzima de membrana, la peroxidasa tiroidea (tiroperoxidasa) que sintetiza H2O2 necesaria para la oxidación del yoduro (Io, I+,HOI2– ). La síntesis de esta enzima se incrementa como consecuencia de la acción de la TSH sobre la célula acinar. También como consecuencia de esta acción, se incrementa la síntesis de una gran proteína tiroidea, formada por dos subunidades de peso molecular igual a 660 kd, muy rica en restos tirosínicos (123 restos), la cual es secretada a la luz coloidal. Esta proteína se denomina TIROGLOBULINA (TG) [15] Además de esta proteína, la albúmina sérica, la caseína, el fibrinógeno y la lisozima sirven artificialmente como sustratos. y actúa como matriz para la síntesis de las hormonas tiroideas. Los restos tirosínicos de esta proteína son semejantes a los de otras proteínas, sin embargo en la TG existen regiones donde la yodación es preferente debido a una relación espacial originada por la estructura terciaria y cuaternaria de esta proteína.
En los restos tirosínicos de la tiroglobulina (tan solo de 4 a 8) se introduce enzimáticamente el yodo oxidado, acción en la que participa la peroxidasa tiroidea. Este yodo oxidado se introduce en la posición 3 del grupo fenólico de una tirosina, dando lugar a la monoyodotironina (MIT o T1). Esta tirosina yodada puede aceptar otro yodo en la posición 5 del grupo fenólico, obteniéndose la diyodotironina o DIT (T2). Este proceso se denomina ORGANIFICACION DEL YODO (figura 7) . Esta yodación se inhibe por excesos de yodo.
Figura 7: Organificación del iodo.
Como siguiente paso de la biosíntesis tenemos, el acoplamiento por condensación de dos tirosinas biyodadas para dar lugar a una tetrayodotironina o T4 o tiroxina; o bien una tirosinabiyodada (3,5) con una tirosinamonoyodada en la posición 3′ para obtener la triyodotironina o T3 , o bien una tirosinabiyodada (3′,5′) con una monoyodada en posición 3 para obtener la triyodotironina inversa o iT3, aunque esta última se da en muy poca proporción. En consecuencia, en cada molécula de tiroglobulina podemos encontrar los siguientes restos de tirosina yodada, MIT: 7; de DIT: 5; de T4: 2 y de T3: 1 de cada tres TG. Si no hay una concentración suficiente de yoduro plasmático la yodación se altera de forma que no se obtiene T4 pero si T3, lo cual supone un mecanismo de adaptación tiroidea a la falta de yoduro.
El almacenamiento de la hormona se realiza en el coloide, para lo cual una vez sintetizada la hormona, la tiroglobulina se separa de la membrana apical y entra a formar parte del coloide (figura 6). Como existe una biosíntesis basal la proporción de tiroglobulina yodada se incrementa, con lo que crece el coloide dando lugar a la típica morfología tisular del tiroides activo.
La secreción está bajo el estímulo de la TSH (figura 6), tras el cual la célula emite seudópodos hacia el coloide englobando gotitas de éste que son ingeridas por pinocitosis, dando lugar a las lagunas de reabsorción morfológicas. En el citoplasma estas gotitas de coloide se incorporan a los lisosomas, donde son digeridas por las enzimas proteolíticas que contiene. La acción proteolítica libera a las tirosinas yodadas, MIT, DIT, T3 y T4. La MIT y DIT son sometidas a la acción de una deshalogenasa tiroidea microsómica liberándose yoduros que entran a formar parte, junto con los captados, del "pool" de yodo intracelular para la biosíntesis de hormona. La producción diaria de este yoduro es de aproximadamente 0.23 mg, de éstos 0.15 mg se reorganifican y el resto es liberado en forma de yoduro a la circulación. Igualmente, una pequeña fracción de MIT y DIT se libera a la circulación aunque estas moléculas no son biológicamente activas. La T 3 y T4, una vez liberadas de la tiroglobulina, son secretadas a la circulación capilar fundamentalmente, donde se unen rápidamente a las proteínas transportadoras. La secreción normal diaria de estas hormonas es de 80 µg para la T 4 y 4 µg para la T 3.
Figura 8: Estructura química de las hormonas tiroideas.
Hay una serie de factores que impiden el proceso biosintético a distintos niveles del mismo. Ya hemos visto como el tiocianato y perclorato, entre otros, inhiben la actividad de la "bomba de yodo"; también hemos visto como la concentración plasmática de I– influye sobre la actividad de la "bomba". Además de estos factores hay otros como las tiocarbamidas (procedentes de la tiourea), que bloquean la reacción de acoplamiento y en algunos casos inhiben la transformación tisular de T4 en T3 (figura 6). Hay un factor natural de origen vegetal, que también inhibe la yodación y por tanto la síntesis de hormonas tiroideas. Este factor se conoce como GOITRINA y se encuentra en la familia de las BRASSICACEAS (habas, col, nabos, etc.). Esta familia contiene el precursor, la progoitrina y el activador el cual es termolábil, por tanto la cocción inhibe la activación de la progoitrina. No obstante existen bacterias intestinales que poseen dicho activador, de forma que el exceso dietético de estos vegetales puede llevar a una disminución en la síntesis de T4 y T3.
Todos estos factores mencionados determinan disminución de la síntesis de hormonas tiroideas y en consecuencia provocan un incremento de la secreción de TSH que lleva a una hiperplasia tiroidea conocida como BOCIO.
HORMONAS TIROIDEAS. TRANSPORTE PLASMÁTICO
Ambas hormonas liberadas por el tiroides se unen inmediatamente a sus proteínas transportadoras. Estas proteínas son tres, la GLOBULINA FIJADORA DE TIROXINA (TBG o GFT) [16]Alfa-globulina glicoprotéica sintetizada en el hígado con un pm de 60kd. Su concentración plasmática es de 2 mg/100 ml y su vida media es de 5 días. Tiene un único punto de fijación a la hormona, con una capacidad de fijación hormonal de aproximadamente 260 mmol/l, lo que supone un 70 a 75 % de la T 4. Puede fijar tanto hormona levógira como dextrógira. Inhibe la fijación, entre otros, el salicilato. , que presenta una gran afinidad pero poca capacidad.
Figura 9: Transporte plasmático de las hormonas tiroideas.
Otra proteína transportadora es la PREALBÚMINA FIJADORA DE TIROXINA (TBPA o PAFT) (TRANSTIRRETINA) [17]Su concentración plasmática es de 25 mg/100ml y su vida media de 2 días. Tiene un único punto de fijación hormonal y su capacidad máxima es de 2570 mmol/l. Puede fijar las formas desaminadas y la T 4, pero no las formas dextrógiras. Los barbitúricos y salicilatos inhiben la fijación, y en resumen posee una gran capacidad pero poca afinidad (10 veces menos que la TBG ). Transporta de un 15 a un 20% de … Continúe leyendo , proteína hepática con un pm de 50Kd y lleva retinol o vitamina A.
La última proteína transportadora es la ALBÚMINA , la cual debido a su concentración plasmática presenta una gran capacidad transportadora, aunque su afinidad es muy baja (1000 veces menos que la TBG ). Transporta de un 5 a un 10% de T4.
En consecuencia la T 4 se encuentra unida en un 99,98%, con una vida media de 6 a 7 días. La T 3 se encuentra unida en un 99,8%, con una vida media menor.
Existe un equilibrio entre las hormonas tiroideas unidas a proteínas y las libres. Siendo las libres las que tienen papel biológico y además regulan la secreción de TSH . Por esta razón, todos aquellos factores que modifiquen la concentración de proteínas transportadoras, modificarán a su vez la actividad biológica de las hormonas tiroideas y su síntesis y secreción. Entre los posibles factores, destacan las hormonas sexuales. Los estrógenos incrementan la síntesis hepática de proteínas transportadoras, con lo que se incrementa la fracción de T4 y T3 unida. La consecuencia inmediata, como puede verse en la figura, es una disminución de T4 y T3 libre, disminución por tanto del efecto inhibitorio de estas hormonas sobre la secreción hipofisaria de TSH e incremento de síntesis y secreción de T4 y T3, hasta llegar a un nuevo punto de equilibrio, donde se alcanzan valores normales de HT libres a costa de un incremento de la HT totales. Incremento de estrógenos se da de forma fisiológica durante el ciclo menstrual y en la gestación, de forma no fisiológica durante el tratamiento con anticonceptivos orales. Los andrógenos tienen un efecto inverso, inhiben la síntesis de proteína transportadora y en consecuencia se incrementa la proporción de T4 y T3 libre.
En la figura 9 podemos ver los porcentajes de unión a las proteínas transportadoras, de las diferentes hormonas tiroideas.
La distinta afinidad de las proteínas transportadoras por la T4 y T3 determinan su vida media en sangre, de forma que la T4 dura entre 7 y 8 días mientras que la T3 dura entre 1 y 1,5 días. (En ratas adultas donde la TBG es muy escasa, la vida media de T4 es de 17 horas y la de T3 es de 12 horas).
En definitiva las proteínas transportadoras suponen un sistema de almacenamiento plasmático de T4 (sustrato de la T3) y además un sistema amortiguador por el cual los incrementos bruscos de T4 no afectarían a los niveles de T3 y en consecuencia a sus acciones biológicas.
Por lo dicho anteriormente y de acuerdo con la figura, del conjunto de T4 en plasma, solo un 0,02% está libre y por tanto con posibilidad de ser activado a T3. Y para la T3 solo el 0,2%. Pero el "pool" plasmático de estas hormonas no solo procede del tiroides, sino de las transformaciones que las desyodasas tisulares realizan sobre dichas hormonas.
HORMONAS TIROIDEAS. DESIODACIÓN TISULAR
Las hormonas tiroideas liberadas por el tiroides o almacenadas en el hígado ("pool extratiroideo" (hígado) 1 µg), puestas en circulación y no unidas a proteínas transportadoras, son las utilizadas por los tejidos diana, donde según las condiciones metabólicas del sujeto, son transformadas de acuerdo a la activación de diferentes desyodasas [18]Las desyodasas se clasifican en tres: las del tipo 1 (5′-yodotirosinasa desyodasa) responsable de la transformación de T4 a T3 y presente en tiroides, hígado, riñón y otros tejidos, y por este orden. Principalmente se encarga de eliminar rT3.La tipo 2 (5’ yodotirosinasa desyodasa) en encéfalo, hipófisis, grasa parda, placenta; que transforma T4 en T3.Y la tipo 3 (5 yodotirosinasa desyodasa) en placenta, … Continúe leyendo tisulares.
La T3 es la más activa de las HT y para ello, debido a la baja producción tiroidea y concentración plasmática, debe obtenerse en los tejidos diana por desiodación de la T 4 libre (monodesiodación del anillo externo de la T 4). La T 4 unida a proteína transportadora y la T 4 almacenada en hígado, representan el total de hormona disponible para ser activada, junto con su larga vida media, aunque todo ello depende del porcentaje de T4 que halla libre.
Figura 10: Desiodación de las hormonas tiroideas.
La monodesyodación se realiza por una 5′-desyodasa presente en muchos tejidos (D1 y D2), aunque la mayor proporción se encuentra en el hígado. Esta vía puede ser alterada por diversos factores entre los que se destacan el ayuno y la fiebre, factores que potencian la conversión de T4 en iT3, y en el recién nacido, donde posiblemente la actividad de la desyodasa sea muy baja. El efecto del ayuno se explica por una disminución del aporte de hidratos de carbono con lo que se reducen los cofactores necesarios para la activación de la desyodasa (el glutatión reducido). En ayunos prolongados superiores a 3 días el nivel plasmático de T3 baja un 50%, sin variar las concentraciones libre y unida de T4 y sube el de la rT3, pero si se prolonga el ayuno los niveles de rT3 vuelven a la normalidad pero los de la T3 siguen disminuidos.
Figura 11: Activación y desactivación de las hormonas tiroideas.
Esta vía metabólica produce el 80% de la T3 circulante, mientras que el 20% restante es de origen tiroideo (T3 circulante (1-3 nmoles/l)). La concentración de T3 varía con la edad, bajando a partir de los 50 años a niveles de 0.5 a 2.5 nmoles/l. En mujeres este descenso es más tardío. Sin embargo la T4 no varía.
Los tejidos (incluido el hígado) también desactivan tanto a la T4 como a la T3, y lo hacen por diferentes vías (que suponen una degradación diaria del 10% de producción hormonal):
1.) la glucurocongujación y sulfatoconjugación hepática con la consiguiente eliminación biliar y urinaria,
2.) la descarboxilación y desaminación de la cadena lateral, formándose acético y dando lugar al ácido tetrayodotiroacético o TETRAC, que aunque tiene el 35% de la actividad de la T4 no tiene efecto fisiológico en el hombre,
3.) monodesyodación del anillo interno de la T4 obteniéndose la iT3, forma inactiva de la T3, mediante una 5-desyodinasa,
4.) la rotura básica de la estructura interna de la tironina por el puente de oxígeno.
La iT3 circulante procede en un 95% de la inactivación tisular de la T3 y en un 5% del tiroides. En ocasiones esta iT3 puede incrementarse, debido a un incremento de la conversión de T3 en iT3 y a una lenta metabolización de la misma.
HORMONAS TIROIDEAS. MECANISMO DE ACCIÓN
La T3 interacciona con receptores localizados en el núcleo de la célula diana. Estos receptores pertenecen a una superfamilia de receptores nucleares para las hormonas tiroideas y los demás esteroides endocrinos. Existen múltiples receptores para la T3, los cuales se organizan en dos familias los a y los ß, y dentro de estas hay subfamilias, así en la hipófisis sólo se encuentran receptores TRß2 , mientras que TRß1 se da en el hígado. La TRa 2 no enlaza con T3. El gen que codifica el tipo ß se encuentra en el cromosoma humano 3, y el que codifica el tipo a se encuentra en el cromosoma 17.
La unión T3-receptor nuclear determina una modificación del proceso de transcripción y traducción genética que lleva a un cambio en la síntesis proteica, que afecta a receptores, enzimas concretas ligadas al metabolismo intermediario celular (cadena respiratoria, enzimas lipolíticas, etc) y a la síntesis de hormona del crecimiento.
Figura 12: Mecanismo de acción de las hormonas tiroideas.
Las acciones citoplasmáticas de la unión R–HT no se conocen bien.
HORMONAS TIROIDEAS. ACCIONES
Es la T3 libre la que realiza las acciones en sus tejidos diana gracias a la conversión por desyodasas de la T4 libre o por uso de la T3 plasmática libre.
Figura 13: Acciones de las hormonas tiroideas.
A su vez los tejidos utilizan de forma distinta la T3, así el músculo utiliza el 100% de la T3 circulante, mientras que el Hígado utiliza un 20% de la T4 en T3; la adenohipófisis un 50% de T4 en T3 y el cerebro un 75 a un 80% de T4 en T3. Esto muestra que para algunos tejidos sea más importante las variaciones plasmáticas de la T4 que de la T3.
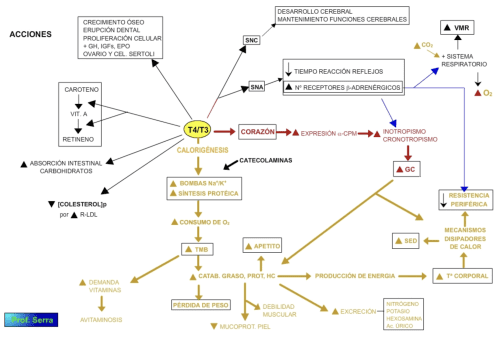
Las HT ejercen diferentes acciones en sus tejidos diana, pero todas ellas encaminadas al control del metabolismo basal (acción calorígena y metabólica) y a procesos de desarrollo y maduración en órganos y tejidos. De la acción calorígena (TMB) de la T3 se desprenden otras acciones que afectan tanto al metabolismo intermediario como a la actividad de otros órganos y sistemas, como a continuación se describe. Muchas de sus acciones son dosis dependiente.
Figura 14: Acciones de las hormonas tiroideas.
La acción calorígena supone incrementar la actividad de la Na +/K+ ATPasa con el consiguiente incremento en el consumo de ATP; ATP que procede de la fosforilación oxidativa gracias al estímulo hormonal de la cadena respiratoria mitocondrial. Lo que supone incremento en el consumo de O2.
En el tejido adiposo pardo y por el incremento que la T3 ejerce sobre el número de receptores beta-adrenérgicos, se produce calor por el consumo mitocondrial de oxígeno sin fosforilación oxidativa (sin ATP), mediante la proteína desacoplante mitocondrial UCP o termogeninas.
El exceso hormonal puede suponer un incremento de más de un 50% del consumo de O2 en el metabolismo basal, y un defecto puede llevar a una disminución de dicho consumo en un 30 a 40%.
Consecuencia de este incremento en el consumo de oxígeno es el incremento de la temperatura corporal media. Por esta razón, la fiebre dirige el metabolismo de la T4 a iT3, pues al disminuir la T3 se evitan incrementos de temperatura. Este incremento de la temperatura produce pérdida de agua e incremento de la sed.
Este efecto calorígeno sobre el consumo de O2 basal es mucho mayor por parte de la T3 que de la T4 y es evidente y desigual en una serie de tejidos, como son: el hígado, sistema muscular, riñón, corazón, etc. Sin embargo hay otros tejidos que no responden a esta acción, como son: el cerebro adulto, testículos, ganglios linfáticos, bazo, útero e hipófisis anterior, como se puede ver en la figura.
Muchas de sus acciones metabólicas son dosis dependientes, como podemos observar en el metabolismo intermediario, donde a dosis fisiológicas ejerce un efecto anabólico, mientras que a dosis altas su efecto es catabólico. Igualmente ocurre en el metabolismo proteico, donde a dosis fisiológicas estimula la síntesis proteica y favorece la acción de la hormona de crecimiento, de ahí su importancia en el crecimiento y desarrollo. En dosis altas, ejerce una acción catabólica con un balance negativo de nitrógeno (excreción urinaria de nitrógeno), excreción urinaria de potasio y pérdida de masa muscular.
En lo referente al metabolismo, potencia los efectos b-adrenérgicos, pero también facilitada la captación de glucosa a nivel del intestino, del músculo y del tejido adiposo y potencia el efecto de la insulina en este respecto. Favorece la acción glucogenolítica de éstas. Se observa un cierto estímulo de la sensibilidad a la insulina. En sujetos con páncreas reducido o lesionado, el incremento de HT origina diabetes, ocasionando cetosis y acidosis.
En metabolismo lipídico su acción es lipolítica al estimular el AMPc en las células adiposas y potenciar la acción de las demás hormonas lipolíticas. Incrementa la beta-oxidación de los ácidos grasos, y a dosis moderadas estimula la síntesis hepática de triglicéridos debido al incremento circulatorio de ácidos grasos libres procedentes del catabolismo periférico. Disminuye el colesterol circulante, porque estimula los mecanismos hepáticos de su eliminación biliar, e incrementa el número de receptores para las lipoproteínas de baja densidad (LBD), las cuales disminuyen su nivel en sangre.
Respecto a las vitaminas, en altas dosis puede ocasionar avitaminosis. Además es necesaria para la transformación de riboflavina en mono y dinucleótido de flavina. Para la transformación de caroteno en vitamina A y vitamina A en retineno.
El incremento del metabolismo y del consumo de oxígeno y de la temperatura corporal media, lleva a que esta hormona realice otras acciones encaminadas a favorecer su acción principal. Así se aumenta el gasto cardiaco, aumentando en el corazón los receptores ß-adrenérgicos para las catecolaminas y la expresión de la alfa-CPM (isoforma de cadena pesada de miosina la cual tiene mayor actividad ATPásica, e induce la piruvato deshidrogenada, con lo que aumenta el volumen sistólico y la frecuencia cardiaca (efecto inotrópico y cronotrópico). Además en el corazón se han encontrado dos adenilatociclasas una que se estimula por la T 3 y otra que se estimula por las catecolaminas.
Igualmente, este efecto potenciador del sistema nervioso autónomo (por incremento de receptores a la NA), determina que se produzca una disminución de la resistencia vascular periférica que favorece la disipación del calor producido, así como un incremento de la velocidad de la sangre (aumenta el aporte sanguíneo a los tejidos). A su vez tanto el incremento metabólico del anhídrido carbónico, como su acción sinérgica del simpático en el sistema pulmonar, favorece que se incremente el refresco de aire y por tanto el suministro de oxígeno.
En la sangre favorece la formación de 2,3-DPG en los eritrocitos, que favorece el intercambio tisular de oxígeno y aumenta la eritropoyetina.
En el sistema digestivo favorece la absorción intestinal de dextrosa y galactosa y la secreción digestiva en general. Estimula así mismo la motilidad del tracto digestivo.
En definitiva, cuando aumenta el nivel de HT libre se produce pérdida de peso, incremento del apetito, de la temperatura corporal media, pérdida de agua por sudoración, incremento de la sed, disminución de colesterol plasmático, aumento del gasto cardiaco y respiratorio, pérdida renal de nitrógeno y potasio; hiperglucemia.
OTROS EFECTOS:
En el músculo esquelético también se ve favorecida la acción contráctil y la biosíntesis de miosina y de enzimas lisosómicas.
Regula el metabolismo óseo y estimula el crecimiento en longitud, el desarrollo y maduración ósea. Estimula la secreción de GH. Promueve el incremento de la actividad de los condrocitos en la placa de crecimiento del hueso. Favorece la osificación y fusión de las placas óseas. También son necesarias para el desarrollo y erupción dental.
En el riñón promueven la diuresis por el incremento del GC, el flujo sanguíneo renal y la TFG. También hay evidencias de que aumenta el PNA y por tanto la natriuresis.
En el sistema nervioso pre adulto, es necesaria para un buen desarrollo cerebral. En el adulto, dependiendo de su dosis se puede pasar de lentitud en el proceso mental (dosis pequeñas) a una mayor agilidad mental y cierta irritabilidad (dosis mayores). Si bien prácticamente todas las células tienen receptores nucleares para las HT, los receptores del sistema nervioso tienen muy baja Km, muy alta afinidad y rápida saturabilidad, lo que hace que este tejido sea muy sensible a la acción hormonal, sobre todo en las etapas del desarrollo. Una de las proteínas reguladas por T3 es el factor de crecimiento neural (NGF), mediador del desarrollo psicomotor, así como también otras proteínas y glucósidos del axón que participan en la mielinización.
Incrementa la serotonina en el cerebro, sobre todo en la corteza cerebral y regula a la baja los receptores 5-HT-2 (Martin et al, 1985 [19]Martin P, Brochet D, Soubrie P, Simon P (September 1985). "Triiodothyronine-induced reversal of learned helplessness in rats". Biol. Psychiatry 20 (9): 1023–5.).
En la piel favorece el flujo sanguíneo cutáneo, el crecimiento del pelo y evita el acumulo de ácido hialurónico y condroitinsulfatos que favorecen el acumulo de agua.
En el sistema reproductor favorece la espermatogénesis y en la mujer favorece el desarrollo, maduración del folículo y la ovulación, posiblemente por su interacción sobre los niveles de hormonas sexuales. Favorece junto con otras hormonas el desarrollo mamario durante la pubertad femenina.
En el feto el eje hipofisotiroideo fetal funciona como unidad que prácticamente es independiente de la madre. Durante la vida fetal el desarrollo somático es en gran medida independiente de las hormonas tiroideas, pero es indudable que condicionan la fase ulterior de la maduración esquelética, influyendo sobre la maduración prenatal tardía del pulmón y se requieren para el desarrollo normal del encéfalo y de la función intelectual antes del nacimiento o poco después, lo cual hace que el diagnóstico de hipotiroidismo neonatal sea de extrema urgencia.
Con respecto a otros ejes hormonales, interviene en los niveles de producción de hormonas gonadotropinas y GH.
Figura 15: Relación de las hormonas tiroideas con otros ejes hormonales.
A su vez las hormonas tiroideas aceleran el catabolismo de la insulina.
Incrementa el número de receptores para las catecolaminas (Bilezikian & Loeb 1983 [20]Bilezikian JP, Loeb J. (1983). The influence of hyperthyroidism and hypothyroidism on alpha and beta adrenergic receptor systems and adrenergic responsiveness. Endocr Rev 4: 378-88.) y aumenta los niveles de AMPc dependiente de la ADH.
Disminuye la secreción de prolactina.
Incrementa la eritropoyetina.
HORMONAS TIROIDEAS. REGULACIÓN
La TRH hipotalámica es la primera hormona del eje que ejerce su control sobre la secreción adenohipofisaria de la TSH. Así la secreción de TRH refleja toda la integración nerviosa que confluye en el hipotálamo endocrino. Además de presentar un ritmo circadiano en su secreción.
Figura 15: Regulación en el eje tiroideo.
Al nivel hipotalámico y en lactantes se produce un efecto estimulador de la secreción de TRH cuando aumenta el frío. En adultos no se ha podido evidenciar. Tiene efecto estimulador los andrógenos, mientras que el aumento de estrógenos produce una disminución de dicha liberación. Respecto al estrés no se sabe si hay una disminución por influjo directo del sistema límbico o el posible efecto inhibitorio se consigue por el incremento del cortisol (con su efecto inhibitorio sobre la liberación de TSH). El ayuno tiene un efecto inhibidor por disminución de la función tiroidea. También la inhibe la SS (somatostatina).
La TSH a su vez estimula la síntesis y secreción tanto de T4 como de T3, las cuales ejercen su acción en los tejidos diana, donde se produce la conversión de T4 en T3 para aumentar la actividad biológica de la T 4 (conversión que depende de la actividad de las diferentes desyodasas reguladas por factores como el ayuno, la fiebre, los glucocorticoides, etc). Éste sería el último nivel de regulación de la actividad hormonal.
Recordar que tanto en el sistema nervioso central como en la hipófisis actúa la T4-5′-desiodasa tipo D1, cuya actividad aumenta en ausencia de hormonas tiroideas y se ve poco afectada por los cambios nutricionales.
Las hormonas tiroideas ejercen un retrocontrol inhibitorio sobre los niveles superiores, donde existen desyodasas que transforman la T 4 en T3 y ésta es la que ejerce la acción inhibitoria. El déficit en estas hormonas supone incremento en la secreción de TSH y crecimiento del tejido glandular o bocio.
Al nivel de la adenohipófisis, intervienen más factores reguladores. Además del principal, la TRH como estimulador y la propia T3 como inhibitoria, tenemos también el posible papel inhibitorio de la SS (somatostatina, al menos a niveles altos). Como inhibidores comprobados, la dopamina del sistema tuberoinfundibular, niveles altos de cortisol (posible papel inhibitorio del estrés) y los factores dependientes de la inflamación (IL1,6 y TNF-alfa). Y como estimuladores los estrógenos de forma directa, aumentando los receptores para la TRH , e indirectamente inhibiendo la liberación de dopamina.
Figura 16: Regulación multiorgánica de las hormonas tiroideas.
En el hígado se realiza otro control por cuanto es el responsable de la producción de las proteínas transportadoras de estas hormonas y por tanto, de la cantidad de hormona libre u hormona activa. En el hígado interaccionan hormonas como las sexuales que controlan la síntesis de estas proteínas. Así los estrógenos la aumentan (disminuye la cantidad de HT libre) y los andrógenos la disminuyen. Por otra parte, la insulina favorece también la síntesis de proteínas transportadoras, y al disminuir el nivel de HT libre, disminuye la acción de éstas sobre el metabolismo glucídico (hiperglucemiante) y por tanto sobre la misma secreción de la insulina. No hay que olvidar que tanto en el hígado como en el riñón actúan la T4-5’desiodasa tipo D2, siendo estos órganos los principales responsables de la T3 circulante. Esta enzima disminuye su actividad en diferentes patologías como el hipotiroidísmo, uremia, la diabetes mellitus, etc.; durante el ayuno prolongado, glucocorticoides, etc. Aumenta su actividad con la administración de T4 y consumo calórico alto.
Al nivel del tiroides otros factores ejercen también control directo en la secreción. Así tenemos la acción inhibitoria de fármacos y la goitrina. También inhibe la GH. Por el contrario las catecolaminas (la adrenalina del sistema adrenal y la NA del SNA) ejercen una acción estimuladora junto con la IGF 1.
Otro mecanismo de auto control a nivel glandular es el conocido como efecto Wolff–Chaikoff, por el cual un incremento importante en la concentración plasmática de yoduro determina una disminución de la captación de éste por el tirocito ( "escape glandular"). La causa parece ser la formación de un compuesto yodado orgánico (XI) que inhibiría a la bomba de yodo. Esta disminución de la captación de yoduro es defensiva, para evitar una sobrecarga de yoduro y excesiva síntesis de hormonas, pero puede llevar a una hipofunción glandular.
HORMONAS TIROIDEAS. ALTERACIONES
La hiposecreción puede venir determinada por:
– deficiencia en la glándula tiroides (supone TSH elevada en plasma)
– reacción autoinmune contra el tiroides, con destrucción de éste (tiroiditis de Hashimoto). (Aunque en los estadios iniciales la glándula es hipersecretora).
– insuficiencia hipotalámica (hipotiroidismo hipotalámico) (la tiroides responde a una prueba de TSH).
– insuficiencia hipofisaria (hipotiroidismo hipofisario) (la tiroides responde a una prueba de TSH), ( la TSH responde a una prueba de TRH)
– deficiencia de Yodo.
– resistencia total o parcial a las hormonas tiroideas.
En adultos da un cuadro conocido como mixedema, cuyas características son: pelo hirsuto, piel seca y amarillenta (carotinemia), frío mal tolerado, voz lenta y ronca (diagnóstico por teléfono), procesos mentales lentos y mala memoria, posible "locura mixedémica". La TMB baja.
En infantes da un cuadro conocido como cretinismo, cuyas características son: enano con retraso mental, barrigón, lengua grande y saliente, etc. El tratamiento hormonal tras el nacimiento puede prevenir este cuadro. (Deficiencia de Yodo en la madre, alteraciones en el eje tiroideo del feto, anticuerpos de la madre contra el tiroides del feto). Durante el embarazo la T4 materna cruza la placenta por lo que las alteraciones fetales del eje tiroideo no influyen hasta el nacimiento. El tratamiento postnatal con HT, si el embarazo ha ido bien, remedia los problemas de desarrollo del infante. Pero si la madre es hipotiroidea y el hijo también el tratamiento es menos efectivo [21]Se estima en unos 20 millones de personas al nivel mundial con problemas graves cerebrales por deficiencia intrauterina de yodo .
Figura 17: Alteraciones en las hormonas tiroideas.
La hipersecreción puede ser debida a:
– tumor hipofisario
– bocio exoftálmico (enf. de Grave) (60 al 80% de los casos)
– alto contenido en Ig G (TSI) [22]Las TSI o inmunoglobulinas G estimuladoras del tiroides, aparecen en casos patológicos donde se crean anticuerpos para los receptores de la TSH , con lo que se produce una sobre estimulación constante de los mismos, con la consecuente hipersecreción de hormonas tiroideas.
– tejido tiroideo ectópico
– tiroiditis
– bocio multinodular tóxico
– mutaciones con activación constitutiva del receptor para la TSH.
La consecuencia es un hipertiroidismo o tiroxicosis que manifiesta los siguientes síntomas: nerviosismo, pérdida de peso, hiperfagia, intolerancia al calor, presión aumentada, temblor fino de los dedos extendidos, piel caliente y suave, metabolismo basal alto, posible exoftalmia (protrusión globos oculares), enfermedades cardiovasculares (insuficiencia cardiaca), insuficiencia hepática (depleción aguda del glucógeno hepático) que lleva a una mala nutrición y a una baja eliminación de hormonas tiroideas. TSH baja.
En la enfermedad de Graves o bocio exoftálmico, el hipertiroidismo viene producido por una reacción autoinmune hacia los receptores de la TSH.
ENLACES DEL TEMA EN LA WEB
- Glándula tiroides
- Medline Plus Medical Encyclopedia
- Wikipedia (T4) - (Hormonas tiroideas)
- Hormona estimulante del tiroides (TSH)
- Examen de la T4
- T3
- Acción de las hormonas tiroideas
- Pruebas de función tiroidea
- Información de Medline Plus Medical sobre las hormonas tiroideas
- Información de Medline Plus Medical sobre el iodo
- Iodo en la dieta
- LA TIROXINA: APORTES DE KENDALL Y HARINGTON
- Test de la T3
VIDEOS
PATOLOGÍAS
- Síndrome de resistencia a la hormona liberadora de tirotropina
2.HIPO E HIPERTIROIDISMO (pdf) - Bocio
- Enfermedades de la tiroides
- Enfermedad de Graves
- Enfermedad de Hashimoto
- Hipertiroidismo
- Hipotiroidismo
- Hipotiroidismo congénito (cretinismo)
- Hipotiroidismo primario
- Hipotiroidismo secundario
- Hipotiroidismo subclínico
- Tiroiditis
BIBLIOGRAFÍA GENERAL
Boelaert K and Franklyn J A. 2005. Thyroid hormone in health and disease. Journal of Endocrinology (2005) 187, 1-15.[Texto completo]
MACLAGAN N. F. AND WILKINSON J. H. (I954).SOME DIFFERENCES IN THE METABOLISM OF THYROXINE
AND TRIIODOTHYRONINE IN THE RAT. J. Physiol. I25, 405-4I5. [Texto completo]
Sir Charles Harington and the structure of thyroxine. Mayo Clin Proc. 1964 Aug;39:553-9. [Texto completo]
![]()














 Views Today : 172
Views Today : 172 Views This Month : 15271
Views This Month : 15271 Views This Year : 30049
Views This Year : 30049 Total views : 399196
Total views : 399196
Un comentario en “T3/T4 – HORMONAS TIROIDEAS”