Ingrese su ID de correo electrónico
FISIOLOGIA / SISTEMA ENDOCRINO / NEUROHIPÓFISIS / H. ANTIDIURÉTICA
HORMONA ANTIDIURÉTICA (ADH) O VASOPRESINA
HORMONA ANTIDIURÉTICA
LA HORMONA ANTIDIURÉTICA (ADH) O VASOPRESINA, ES UNA HORMONA DE LA NEUROHIPÓFISIS CUYO PRINCIPAL PAPEL ES EL DE PRESERVAR EL AGUA CORPORAL.
OBJETIVOS
- Describir y comprender los mecanismos de regulación de la secreción de vasopresina.
- Conocer las acciones fisiológicas de la vasopresina.
- Conocer y entender los efectos del aumento o el déficit de secreción de vasopresina.
- Entender la respuesta fisiológica de la neurohipófisis ante una alteración del volumen o la osmolaridad plasmática.
ADH. CARACTERÍSTICAS GENERALES
La hormona antidiurética o ADH (también conocida como argipresina, arginina-vasopresina (AVP) o vasopresina) es un péptido de 9 aa que tiene una estructura química muy similar a la oxitocina. Ambas son nonapéptidos cíclicos debido a un enlace disulfuro entre los residuos de cisteína en la posición N-terminal y la cisteína de la posición seis. La diferencia entre ambas radica en dos aminoácidos. El aminoácido de la posición 3, fenilalanina para la ADH e isoleucina para la OT. Y el aminoácido de la posición 8, arginina para la ADH y leucina para la OT. En la familia de los suidos (cerdo), la arginina de la posición 8 de la ADH está reemplazada por la lisina, en el resto de los mamíferos todas las ADH son iguales[1]En los vertebrados no mamíferos (aves y peces) se sintetiza una hormona que se denomina arginina–VASOTOCINA (AVT), la cual posee una isoleucina en la posición 3 (como la OT) y una arginina en la posición 8 (como la ADH). Esta molécula es probablemente el origen ancestral de las dos hormonas en los mamíferos. Además, en la glándula pineal se ha identificado un péptido con la misma estructura que la arg-vasotocina. Este péptido es … Continúe leyendo .
Figura 1: Hormona antidiurética. Estructura.
La actividad presora de extractos de la adenohipófisis fué detectada por Oliver and Schäfer en 1895[2]OLIVER, G. & SCHXFER, E. A. (1895). On the physiological action of extracts of pituitary body and certain other glandular organs. J. Physiol. 18, 276-279..
La actividad antidiurética por Konschegg & Schuster en 1915[3]Konschegg, A., and Schuster, E. (1915). Dtsch. med. Wschr., 41, 1091.. La idea de que se secretan por separados la ADH y OT la aportó Theobald en 1953[4]THEOBALD G. W. (1959). THE SEPARAIE RELEASE OF OXYTOCIN AND ANTIDIURETIC HORMONE. J. Physiol. 149, pp. 443-461. [Texto completo]. Se encuentra distribuída en casi todos los mamíferos (Caldwell & Young, 2006[5]Caldwell .H. K. Young, III W. S. (2006) Oxytocin and Vasopressin: Genetics and Behavioral Implications. In Lajtha A, Lim R. Handbook of Neurochemistry and Molecular Neurobiology: Neuroactive Proteins and Peptides (3rd ed.). Berlin: Springer. pp. 573–607. [Texto completo])
ADH. BIOSÍNTESIS, NEUROSECRECIÓN, VIDA MEDIA, TRANSPORTE Y METABOLIZACIÓN
Esta hormona se sintetiza y almacena en neuronas magnocelulares osmorreceptoras, principalmente del núcleo supraóptico hipotalámico y núcleo paraventricular, cuyas terminales pasan el infundíbulo y tallo hipofisario para secretar en la neurohipófisis. Estas neuronas reciben también información osmorreceptora de otras regiones como el órgano vasculoso de la lámina terminal (OVLT) y el órgano subfornical (OSF) situados en la pared anterior del tercer ventrículo[6]Estos órganos proyectan también al núcleo mediano o núcleo preóptico medial implicado en la conducta de la sed..
Figura 2: Biosíntesis y secreción de la ADH.
La síntesis se realiza a partir de un gen (cromosoma 20 p13 ) que origina una preprohormona. La preprohormona de la ADH muestra una glicoproteína en la región C-terminal. De esta preprohormona hay un péptido señal de 19 aa, seguido de un péptido de 9 aa que es la hormona y después un péptido de 95 aa que es la neurofisina II (NPII) (20 KDa) (o nicotin-dependiente) que se une a los tres primeros aa de la hormona y forma enlaces no covalentes con distintos lípidos. En la preprohormona de la ADH hay un glucopéptido en la región C-terminal formado por 39 aa. El papel funcional de esta neurofisina parece ser el de estabilizar la hormona dentro del gránulo secretor, así como favorecer el transporte axónico de la hormona e incluso en sangre incrementar la vida media de la misma.
En el aparato de Golgi es empaquetada la hormona junto con su neurofisina y así viajan por el axón hacia el terminal axónico con una velocidad de 2 a 3 mm/hora. Estas vesículas (cuerpos de Herring) son almacenadas en las terminales nerviosas en botones axónicos terminales y no terminales (este almacenamiento permite el máximo efecto antidiurético durante 7 a 10 días). Cuando llega el potencial de acción, se produce despolarización de la membrana del terminal e influjo de sodio con la consiguiente apertura de canales de calcio voltaje dependientes. Esta entrada de calcio es el estímulo para la exocitosis vesicular. Una vez liberado el contenido la membrana vesicular es reutilizada, restaurándose a la vez el potencial de membrana de la terminal. En el proceso de exocitosis normalmente se produce la separación de la hormona de su neurofisina.
La vida media en sangre para la ADH es de unos 10 minutos. Los niveles en sangre son de muy pocos picogramos/ml. Se metabolizan en hígado, riñón y cerebro. Se excreta a razón de 34±10 ng/día en hembras y de 71±46 ng/día para varones.
ADH. MECANISMO DE ACCIÓN
El mecanismo de acción de esta hormona es mediado por receptores de membrana que son distintos según los tejidos diana, por cuanto son dos los segundos mensajeros que se activan.
Figura 3: Mecanismo de acción de la ADH.
Los receptores denominados V1a (AVPR1A) que activan el sistema del fosfoinositol y en consecuencia el incremento de calcio iónico intracelular, en músculo liso vascular, hígado, riñón y cerebro.
Los receptores V1b (AVPR1B) que activan también el sistema del fosfoinositol y en consecuencia el incremento de calcio iónico intracelular, en glándula pituitaria y cerebro.Los receptores V2 (AVPR2) que activan el sistema del AMPc en riñón (membrana basolateral del conducto colector)(Robben et al., 2006[7]Robben JH, Knoers NV, Deen PM (2006). "Cell biological aspects of the vasopressin type-2 receptor and aquaporin 2 water channel in nephrogenic diabetes insipidus.". Am. J. Physiol. Renal Physiol. 291 (2): F257–70.).
Los VACM-1(CUL-5) que activan también el sistema del fosfoinositol y en consecuencia el incremento de calcio iónico intracelular, en endotelio vascular y túbulos colectores renales.
ADH. ACCIONES
Figura 4: Acciones de la ADH.
La principal acción periférica que se le atribuye a esta hormona es la de preservar el agua corporal. Por ello el principal órgano diana es el riñón y dentro de él actúa en diferentes sitios. Afecta a la resistencia de los vasos rectos, por lo que disminuye el flujo sanguíneo medular; por otro lado contrae las células mesangiales por lo que reduce la tasa de filtración glomerular: estimula el transporte activo del sodio desde el asa ascendente gruesa de Henle e incrementa la permeabilidad a la urea en el túbulo colector medular (activando dos transportadores diferentes de urea el UT-A1 y el UT-A3) efecto mediado por la fosfolipasa C, por lo que favorece el gradiente hiperosmolar cortico-medular. En el túbulo distal del riñón, donde a través de receptores AVPR2 (acoplados a la proteína G) (cromosoma X 152.82 – 152.83 Mb) y por tanto del AMPc incrementa la permeabilidad tubular al agua, urea y otros solutos (en el túbulo contorneado distal y conducto colector) (Promeneur et al., 1997[8]PROMENEUR D., BANKIR U., MING-CHANG HU, and TRINH-TRANG-TAN M-M . (1998). Renal Tubular and Vascular Urea Transporters: Influence of Antidiuretic Hormone on Messenger RNA Expression in Brattleboro Rats. J Am Soc Nephrol 9: 1359-1366. [Texto completo]), pasando al parénquima renal gracias a un gradiente favorable. Este efecto se consigue por la presencia de endosomas cargados de permeasas (acuaporinas 2). Estos endosomas bajo la acción del AMPc se fusionan con la membrana luminal incrementando la superficie permeable. Una vez terminado el efecto de la ADH se vuelven a producir endosomas, por lo que la superficie de la membrana vuelve a su superficie original. Además produce una disminución del flujo sanguíneo en la medula renal (Rasmussen 1975[9]Rasmussen S. N. (1975). Effects of Antidiuretic Hormone on Intrarenal Red Cell and Plasma Volumes in the Water Diuretic Rat. Pfliigers Arch. 361, 69-73. [Texto completo]; Johnson et al., 1977[10]Johnson M. D., Park C. S. and Malvin R. L. (1977). Antidiuretic hormone and the distribution of renal cortical blood flow. Am J Physiol Renal Physiol 232: F111-F116, . [Abstract]) y estimula la liberación renal de Prostaglandinas E2 que frenan su acción renal. Las hormonas tiroideas pueden afectar a la adenilato ciclasa sensible a la ADH. Así en hipotiroideos tanto la actividad adenilato ciclasa basal como la estimulada por la ADH está disminuida.
En los glomérulos renales se ultra filtran 180 l/día de plasma, de los que se reabsorben 178,5 l en los túbulos renales y se excretan aproximadamente 1,5 L . Del total reabsorbido sólo de 1/6 a 1/8 se ve afectado por la ADH (reabsorción facultativa), mientras que el resto no se ve afectado por dicha hormona, conociéndose como la reabsorción obligatoria.
En el sistema circulatorio, produce elevación de la presión arterial y constricción de las arterias coronarias y pulmonares a través de receptores AVPR1A, pero no de las cerebrales y renales. No obstante los valores fisiológicos de esta hormona no alcanzan los niveles requeridos para realizar dichas acciones.
A través de receptores AVPR1A estimula la agregación plaquetaria y la liberación del factor VIII y von Willebrand (también con el AVPR2 (Kaufmann et al., 2000[11]Kaufmann JE, Oksche A, Wollheim CB, Günther G, Rosenthal W, Vischer UM (2000). "Vasopressin-induced von Willebrand factor secretion from endothelial cells involves V2 receptors and cAMP". J. Clin. Invest. 106 (1): 107–16. [Texto completo]).
En el sistema gástrico disminuye el volumen de secreción (posiblemente por su efecto vasoconstrictor) e incrementa la motilidad gástrica y del colon.
En el hígado también tiene efectos, estimulando la liberación de glucosa por activación de la glucogenólisis, y la captación de potasio. Es un efecto similar al producido por los agonistas alfa-adrenérgicos. Este efecto lo consigue gracias al incremento del calcio iónico libre intracelular mediante el sistema del IP3, y por tanto son receptores AVPR1A a los implicados en esta acción.
En el sistema nervioso central la ADH como neurotransmisor o neuromodulador, lo hace siguiendo un ritmo circadiano (sobre todo la procedente del núcleo supraóptico).
Está implicada en la consolidación de la memoria y el aprendizaje mediado por AVPR1A (Acuaporinas 4)(se deben a los compuestos lisina y arginina-ADH). También en la regulación de la presión y regulación de la temperatura.
También está implicada en el emparejamiento y en mamíferos machos con tendencia a formar pareja, efectos importantes en el establecimiento de fidelidades sexuales, territorialidad agresiva y vigilancia y defensa de las crías (Bielsky et al., 2004[12]Bielsky IF, Hu SB, Szegda KL, Westphal H, Young LJ (2004). "Profound impairment in social recognition and reduction in anxiety-like behavior in vasopressin V1a receptor knockout mice".Neuropsychopharmacology 29 (3): 483–93.); Heinrichs et al., 2009[13]Heinrichs M, von Dawans B and Domes G. (2009). Oxytocin, vasopressin, and human social behavior. Frontiers in Neuroendocrinology Volume 30, Issue 4, Pages 548-557. [Abstract]; Walum et al., 2008[14]Walum H, Westberg L, Henningsson S, Neiderhiser JM, Reiss D, Igl W, Ganiban JM, Spotts EL, Pedersen NL, Eriksson E, Lichtenstein P (2008). "Genetic variation in the vasopressin receptor 1a gene (AVPR1A) associates with pair-bonding behavior in humans". Proc. Natl. Acad. Sci. U.S.A. 105 (37): 14153–6. [Texto completo]), así como en la erección y eyaculación.
Potencia la liberación de ACTH por la CRH a través de receptores AVPR1B (Lolait et al., 2007[15]Lolait SJ, Stewart LQ, Jessop DS, Young WS, O’Carroll AM (2007). "The hypothalamic-pituitary-adrenal axis response to stress in mice lacking functional vasopressin V1b receptors". Endocrinology 148(2): 849–56. [Texto completo]).
ADH. REGULACIÓN
La misión principal de la ADH periférica es preservar el volumen hídrico corporal, en consecuencia los estímulos que regulan su secreción son por orden de importancia:
– la osmolalidad del plasma
– el volumen sanguíneo
– la presión arterial media
Figura 5: Regulación de la secreción de la ADH.
 El primer estímulo es la osmolalidad del plasma. Los osmorreceptores se encuentran en el hipotálamo anterior y órganos de la pared anterior del tercer ventrículo (órgano vasculoso de la lámina terminal (OVLT) y el órgano subfornical (OSF)) y mandan sus señales a través de vías colinérgicas que activan a las neuronas ADH, así como a las neuronas del "centro de la sed" en el hipotálamo anterior. Un incremento en un 1% de la osmolalidad normal del plasma (287 mOsmol/Kg) es suficiente para activar la secreción de ADH. Variaciones superiores al 3% (295 mOsmol/Kg) activan el "centro de la sed". En este "centro de la sed" están implicados los órganos subfornical y subcomisural, seguramente como sensores de la osmolalidad del LCR. La angiotensina que controla la pérdida de sal actúa sobre el órgano subfornical.
El primer estímulo es la osmolalidad del plasma. Los osmorreceptores se encuentran en el hipotálamo anterior y órganos de la pared anterior del tercer ventrículo (órgano vasculoso de la lámina terminal (OVLT) y el órgano subfornical (OSF)) y mandan sus señales a través de vías colinérgicas que activan a las neuronas ADH, así como a las neuronas del "centro de la sed" en el hipotálamo anterior. Un incremento en un 1% de la osmolalidad normal del plasma (287 mOsmol/Kg) es suficiente para activar la secreción de ADH. Variaciones superiores al 3% (295 mOsmol/Kg) activan el "centro de la sed". En este "centro de la sed" están implicados los órganos subfornical y subcomisural, seguramente como sensores de la osmolalidad del LCR. La angiotensina que controla la pérdida de sal actúa sobre el órgano subfornical.
 No hay que olvidar los experimentos de Verney en 1947[16]Verney, E. B. (1947). The antidiuresic hormone and the factors which determine its release, Proc. Roy. Soc. B, 185, 25., actualmente ratificados in vitro, donde la perfusión del cuerpo carotídeo con diferentes soluciones osmolares, determinaban un cambio en la diuresis (soluciones hiperosmóticas generan incremento de la frecuencia de descarga de sus células y una clara disminución de la diuresis y viceversa) y su probable relación con la secreción de la ADH.
No hay que olvidar los experimentos de Verney en 1947[16]Verney, E. B. (1947). The antidiuresic hormone and the factors which determine its release, Proc. Roy. Soc. B, 185, 25., actualmente ratificados in vitro, donde la perfusión del cuerpo carotídeo con diferentes soluciones osmolares, determinaban un cambio en la diuresis (soluciones hiperosmóticas generan incremento de la frecuencia de descarga de sus células y una clara disminución de la diuresis y viceversa) y su probable relación con la secreción de la ADH.
El segundo estímulo importante es el cambio de volumen plasmático, sensible a disminuciones mayores de un 5%, propuesto por Peters en 1935[17]Peters, J. P. 1935. Body Water. Charles C. Thomas, Springfield.. Estos dos estímulos interaccionan entre sí de forma que la respuesta a uno de ellos está condicionada al otro estímulo. Los sensores de volumen se localizan en el denominado sistema de capacidad, es decir aurículas, venas pulmonares y aparato yuxtaglomerular renal. Estos sensores mandan su información a través del vago sensorial, de forma que mientras no haya cambios en el volumen la señal que viaja de estos sensores es una descarga tónica que al llegar al hipotálamo libera NA la cual inhibe la secreción de ADH-NPII. En el momento que se produce disminución de volumen plasmático, se produce una disminución proporcional de la descarga tónica que se traduce en disminución proporcional de la liberación de NA y en consecuencia, incremento proporcional de la liberación de ADH-NPII. Este reflejo se denomina reflejo de Henry-Gauer, y explica las variaciones en la secreción de ADH-NPII de acuerdo con la postura del sujeto, la ingravidez, la inmersión de la parte inferior del cuerpo, etc. Aunque se requieren mayores cambios de volumen plasmático para estimular la secreción de ADH, ésta es de mayor magnitud que la originada por la osmolalidad. (Ver SEGAR & WARD 1968[18]SEGAR W. E. & WARD W. M. (1968) The Regulation of Antidiuretic Hormone Release in Man. I. EFFECTS OF CHANGE IN POSITION AND AMBIENT TEMPERATURE ON BLOOD ADH LEVELS. J Clin Invest. 47 (9): 2143-2151 [Texto completo]).
Figura 8: Control cardiovascular de la ADH. Reflejo de Henry-Gauer.
El tercer estímulo es la disminución de la presión arterial media (cambios mayores del 10%), cuyos receptores se ubican en el denominado sistema de presión, es decir, receptores carotídeos, aórticos y ventriculares, los cuales mandan su información a través de las ramas sensoriales del glosofaríngeo y el vago, de forma análoga a la comentada anteriormente.
Además de estos estímulos indicados, existen otros factores que estimulan la secreción de ADH-NPII como el estrés agudo, dolor, reflejo orofaríngeo, náuseas (genera un aumento de la ADH entre 100 a 1000 veces), vómito, hipertermia, agonistas colinérgicos y los agonistas alfa1, ANGII, IL1. También el ejercicio muscular intenso, la hipotensión y la hipoglucemia, la hipoxia y la hipercapnia. La nicotina a través del sistema dopaminérgico central.
Inhibidores reconocidos son: la hipotermia, niveles altos de cortisol, agonistas alfa-adrenérgicos, el PNA, el alcohol y los opioides. El etanol también actúa como antagonista de la ADH en los túbulos colectores evitando así la reabsorción de agua.
La secreción de ADH-NPII sigue un ritmo circadiano con un pico máximo hacia la mitad del periodo de luz.
La ADH encefálica se estimula por el apareamiento mantenido durante un tiempo Winslow et al., 1993[19]Winslow, J.T., Hasting, N, Carter, C.S., Harbaugh, C.R., y Insel, Th. R. (1993). "A role for central vassopressin in pair bonding in monogamous prairie voles", Nature, 365, pp. 545-548..
ADH. ALTERACIONES
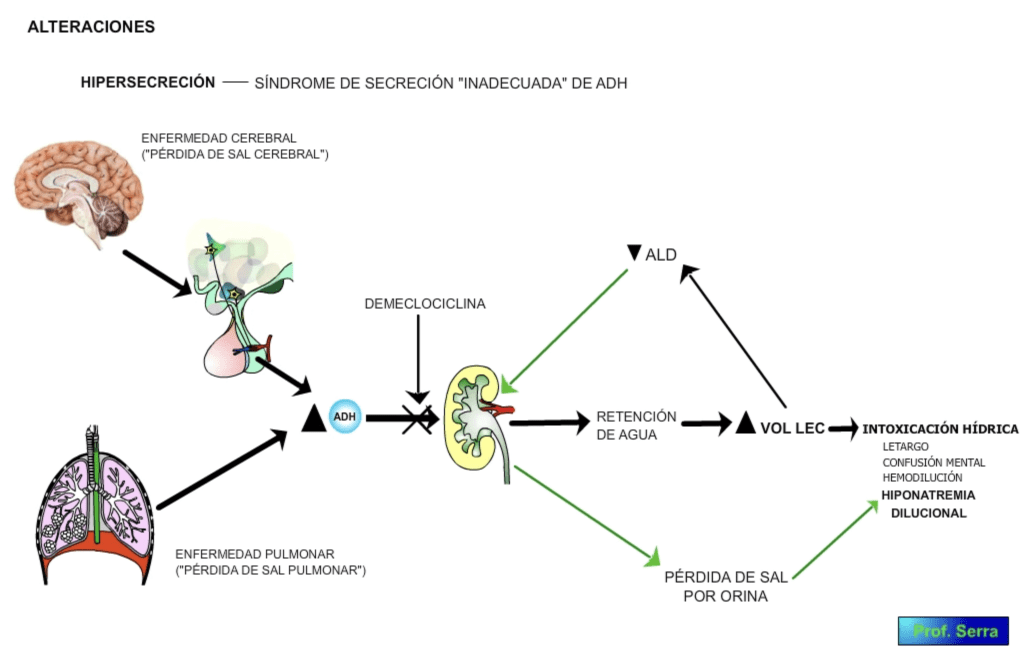
HIPERSECRECIÓN (figura 10):
Los niveles altos de ADH en sangre, también conocido como síndrome de la secreción "inapropiada" de ADH, determinados por enfermedad cerebral (lesión, irritación nerviosa, sustancias estimulantes de la secreción de ADH) (pérdida de sal cerebral), o producción ectópica (como ocurre en el cáncer de pulmón) (pérdida de sal pulmonar), provoca una anti diuresis que supone intoxicación hídrica, con síntomas como letargo, confusión mental, aumento de peso, hemodilución, hiponatremia, etc. Esta última se produce por la activación de los mecanismos natriuréticos activados por la hipervolemia.
Figura 10: Hipersecreción de ADH. Síndrome de secreción inadecuada de >ADH.
El tratamiento con democlociclina que inhibe la respuesta renal a la ADH tiene un buen resultado.
HIPOSECRECIÓN (figura 11):
Los niveles disminuidos de ADH en sangre o la resistencia renal a la ADH , originan la diabetes insípida: incapacidad del organismo para formar una orina concentrada, con una pérdida de 8 a 10 litros/día (poliuria) y genera un incremento de la ingestión de grandes cantidades de agua (polidipsia), si el centro de la sed está intacto, de lo contrario se produce hipovolemia, hipotensión y muerte. Las causas de esta disminución pueden ser: lesión hipotalámica, tumor, lesión hipofisaria, factores hereditarios (falta de síntesis de ADH), o nefrógena por incapacidad del túbulo para responder a la ADH.
Figura 11: Hiposecreción de ADH. Diabetes insípida.
Un 30% son debidas a lesiones neoplásicas del hipotálamo; un 30% de tipo postraumático; un 30% idiopáticas; y el resto por lesiones vasculares, infecciones, enfermedades sistémicas (sarcoidosis), nefrógenas (falta de receptores V2 (ligado al cromosoma X) o mutaciones en las acuaporinas tipo 2 y mutaciones génicas de las neurofisinas.
Si es por alteraciones en la ADH, el tratamiento con ADH más clorpropamida (incrementa la respuesta renal a la ADH ), es adecuado.
Una forma de distinguir el origen de la alteraciones es midiendo aquoporinas en orina, si hay es de origen hipotalámico, si no las hay probablemente es de origen nefrógeno.
ENLACES DEL TEMA EN LA WEB
Medline Plus Medical Encyclopedia
Wikipedia (ADH)
Enciclonet (Universidad de Sevilla)
A role for central vasopressin in pair bonding in monogamous prairie voles
Enhanced partner preference in a promiscuous species by manipulating the expression of a single gene
Genetic variation in the vasopressin receptor 1a gene (AVPR1A) associates with pair-bonding behavior in humans
Vasopresina y el corazón
Study Links Gene Variant in Men to Marital Discord
ARGININE VASOPRESSIN RECEPTOR 1B; AVPR1B
DESMOPRESINA (ANÁLOGO QUÍMICO DE LA VASOPRESINA)
VIDEOS
PATOLOGÍAS
Patología de la neurohipófisis. Diabetes insípida.
Diabetes insípida (MedlinePlus)
BIBLIOGRAFÍA GENERAL
FISIOLOGIA / SISTEMA ENDOCRINO / NEUROHIPÓFISIS / H. ANTIDIURÉTICA
![]()









 Views Today : 164
Views Today : 164 Views This Month : 15263
Views This Month : 15263 Views This Year : 30041
Views This Year : 30041 Total views : 399188
Total views : 399188