Ingrese su ID de correo electrónico
FISIOLOGIA / SISTEMA ENDOCRINO / EJE HORMONAL SEXUAL FEMENINO/ ESTRÓGENOS OVÁRICOS
ESTRÓGENOS
ESTRADIOL
EL ESTRADIOL ES EL PRINCIPAL ESTRÓGENO DE ORIGEN OVÁRICO CIRCULANTE EN LA ETAPA ADULTA. ES UN ESTEROIDE CUYA ACCIÓN VARIA DE ACUERDO CON LA ETAPA DEL DESARROLLO DEL SUJETO. ACTUANDO SOBRE EL METABOLISMO Y SOBRE LA SEXUALIDAD.
OBJETIVOS
- Describir la regulación hormonal de la biosíntesis de estrógenos y progesterona y su secreción por el ovario. Identificar las células productoras de estrógenos y progesterona, su biosíntesis, mecanismos de transporte, metabolismo y eliminación.
- Listar los órganos o tipos celulares diana de la acción de los estrógenos y describir sus efectos en cada uno de ellos.
- Describir los mecanismos celulares de acción de los estrógenos.
- Enumerar las principales acciones fisiológicas de la progesterona, órganos o tipos celulares diana, y sus efectos en cada uno de ellos.
- Describir los mecanismos celulares de acción de la progesterona.
- Representar gráficamente en el tiempo los cambios endometriales y ováricos observados durante el ciclo ovárico y correlacionarlos con los cambios en los niveles sanguíneos de FSH, LH, estradiol, progesterona e inhibina. Describir como estos cambios en los esteroides ováricos producen las fases proliferativa y secretora a nivel endometrial y la menstruación, así como los cambios en la temperatura corporal basal durante el ciclo ovárico.
ESTRÓGENOS. ORIGEN, BIOSÍNTESIS, SECRECIÓN, TRANSPORTE Y METABOLIZACIÓN
Las hormonas sexuales tanto masculinas como femeninas que encontramos en el plasma de la mujer forman parte del eje sexual femenino (figura 1), aunque algunas no provengan de los órganos endocrinos sexuales. Las hormonas sexuales femeninas son: el ESTRADIOL (con importante actividad hormonal), la ESTRONA y su derivado sulfatado (con menor actividad hormonal, actuando como reservorio de estradiol), el ESTRIOL (metabolito derivado con muy poca actividad hormonal y niveles altos durante el embarazo, de origen placentario) y la PROGESTERONA (característica al final del ciclo ovárico). En cuanto a las hormonas masculinas presentes en el plasma femenino son: la ANDROSTENODIONA, DEHIDROEPIANDROSTERONA y la TESTOSTERONA.
Figura 1: Eje hormonal sexual femenino.
Orígenes:
Los orígenes de estos esteroides varía según los midamos en la fase fértil de la mujer o no.
Fase no fértil:
El estradiol procede en una muy pequeña cuantía del ovario, pero la mayor proporción viene de la transformación de la estrona la cual, en casi un 100%, procede del tejido adiposo [1]Es importante tener en cuenta la masa de tejido adiposo por su participación en los valores finales de esteroides sexuales en sangre. Si está muy aumentado, el nivel de estrógenos procedentes de esta fuente puede equiparar o superar a la procedente del ovario. Esto es bueno para la conservación de la masa ósea, pero malo para la proliferación endometrial y su malignización. Este incremento de la masa adiposa puede llevar a un hiperandrogenismo asociado al … Continúe leyendo por aromatización de la androstenodiona procedente de las glándulas suprarrenales. La testosterona se produce en el tejido adiposo por transformación a partir, fundamentalmente, de la androstenodiona y menos de la DHEA de las glándulas suprarrenales. (Grodin et al., 1973 [2]Grodin JM, Siiteri PK, MacDonald PC. (1973). Source of estrogen production in postmenopausal women. J Clin Endocrinal Metab. 26:207).
Fase fértil:
La fase fértil de la mujer coincide con el ciclo ovárico o menstrual, donde la actividad de las células ováricas frente a la acción de las gonadotropinas supone la formación de andrógenos y su transformación en estradiol que es la principal hormona sexual femenina, así como de progesterona en la segunda fase del ciclo. Por tanto, la mayoría de los estrógenos circulantes son de origen ovárico (estructuras foliculares y cuerpo lúteo). Sin embargo, aproximadamente un 40% de la actividad estrogénica procede del tejido adiposo, por la conversión en éste de parte de la androsteneidona suprarrenal en estrona y su posterior conversión en estradiol.
La testosterona circulante procede tanto del ovario como del tejido adiposo ya que en este último se transforma la DHEA procedente de las glándulas suprarrenales y la androstenodiona procedente de estas glándulas y del ovario en testosterona (figura 2). (Baird & Fraser 1974[3]Baird DT, Fraser IS. (1974). Blood production and ovarian secretion rates of estradiol – 17B and estrone in women throughout the menstrual cycle. J Clin Endocrinol Metab. 38:1009)
Figura 2:Orígen de las hormonas sexuales durante la fase fértil.
En esta fase fértil de la mujer, las células ováricas implicadas en la producción de esteroides sexuales son las intersticiales (células de la teca), diseñadas para producir andrógenos. Las granulosas foliculares, están diseñadas para producir estrógenos. Estas últimas células, bajo la acción hormonal de la FSH y una vez el folículo ha liberado el óvulo, comienzan a producir y liberar estrógenos, sobre todo progesterona y otras moléculas implicadas en la adecuación del endometrio y regulación de la secreción gonadotrófica. Se sabe que cada folículo, en función de sus células granulosas y las características propias del mismo, puede ser más productor de andrógenos o más productor de estrógenos (McNatty, 1981[4]McNatty, K.P. (1981). Hormonal correlates of follicular development in the human ovary. Aust. J. Biol. Sci. , 34:249.).
Las células de la teca tienen receptores para la LH modulados por los niveles de FSH y estradiol, de forma que ante su presencia sintetizan y liberan al plasma androstenodiona y testosterona. Éstas pasan a las células granulosas del folículo y bajo la influencia de la acción de la FSH y LH, son transformados respectivamente en estrona y estradiol que son liberadas al antro. Los receptores para estas gonadotropinas cambian en función del tiempo y la presencia de estrógenos en el antro, haciéndose cada vez más sensibles, hasta que en la fase lútea, la progesterona disminuye la secreción de dichas gonadotropinas y disminuye la sensibilidad a las mismas (figura 3).
Figura 3: Origen de los esteroides sexuales femeninos durante la etapa fértil.
En la fase lútea la progesterona, bajo estímulo de la LH, procede tanto de las células tecales como de las granulosas, además del estradiol y otros esteroides masculinos.
La FSH también estimula en las células granulosas la síntesis y liberación de inhibina alfa y beta, hormona que inhibe la secreción de FSH por parte de la adenohipófisis.
El estradiol es también producido en el cerebro y paredes vasculares, por transformación enzimática de los andrógenos circulantes.
El estriol es un metabolito con poca actividad hormonal que procede de la desactivación hepática del estradiol. Sin embargo, sus niveles suben de forma importante durante el embarazo, dado que en la placenta se transforma el 16-OH DHEAS (originado en el hígado fetal y en las suprarrenales) en dicho metabolito [5]La placenta produce pregnenolona y progesterona. La pregnenolona es transformada por la glándula suprarrenal fetal en dehidroepiandosterona (DHEA) y su derivado sulfatado ()DHEAS), la cual es transformada en el hígado fetal en 16-OH-DHEAS que la placenta convierte en estriol..(Raju et al., 1990[6]Raju U, Bradlow HL, Levitz M (1990). "Estriol-3-sulfate in human breast cyst fluid. Concentrations, possible origin, and physiologic implications". Ann. N. Y. Acad. Sci. 586: 83–7.).
En la figura (figura 4) podemos ver las estructuras químicas de las diferentes moléculas con actividad hormonal. Los estrógenos son esteroides de 18 átomos de carbono por aromatización de los andrógenos.
Figura 4: Estructura química de las hormonas sexuales.
Los niveles en plasma de los esteroides sexuales durante la etapa fértil varían en función del ciclo ovárico. En la fase folicular temprana la secreción de andrógenos es mayor que la de estrógenos (260 µg(día) y (60 µg/día). Sin embargo en la fase folicular media y tardía, la secreción de estrógenos supera a la de andrógenos, con unas tasas de secreción de unos 400 a 900 µg/día. Durante la fase luteica la secreción de estradiol es de unos 300 µg/día, mientras que la progesterona alcanza valores de miligramos (25 mg/día).
En la etapa no fértil estos valores son muy estables pues dependen de la glándula suprarrenal y del tejido adiposo, aunque los valores de estrona son mayores que los de estradiol, por su conversión a partir de la androstenediona en el tejido adiposo.
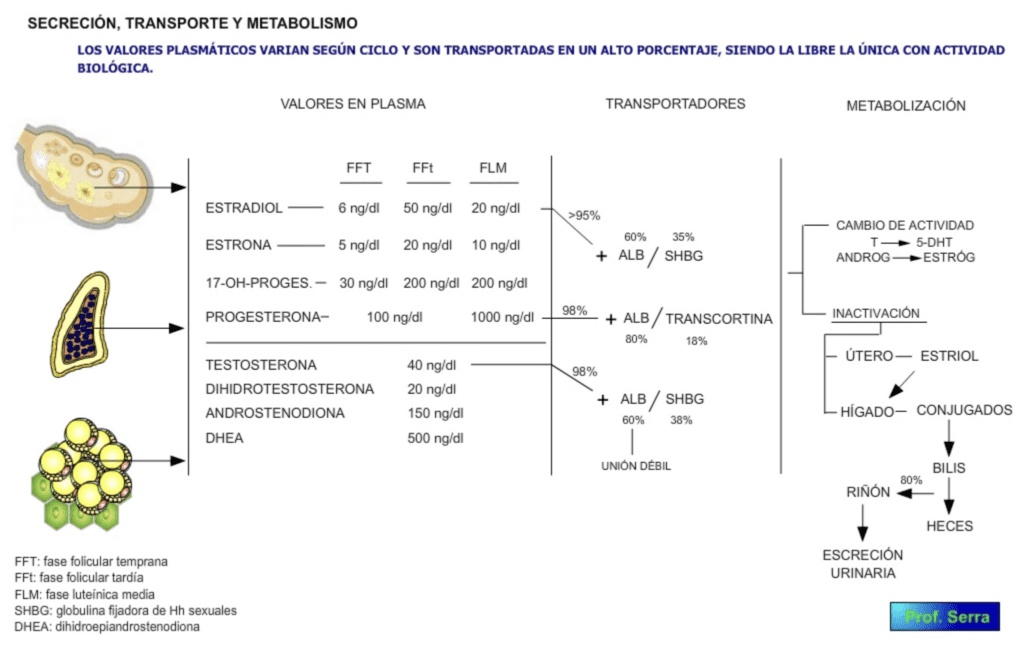
Figura 5: Secreción, transporte y metabolismo de las hormonas femeninas.
Liberados en plasma (figura 5) se unen a proteínas transportadoras como la albúmina y la beta-globulina fijadora de hormonas sexuales (SHBG) de origen hepático. Estructuralmente tiene bastante homología con la TeBG (globulina fijadora de testosterona) intratesticular. Une todas las hormonas sexuales con diferentes grados de afinidad, siendo mínimo para la progesterona, la cual utiliza como proteína transportadora a la transcortina. Como siempre los niveles de hormona libre son los que tienen actividad biológica, luego la regulación hepática de la síntesis de estas proteínas definirá la actividad de estas hormonas. Como se ve en la figura el porcentaje de hormona libre es muy pequeño (<5%), aunque en el caso de la testosterona su disponibilidad biológica es mayor (aprox. el 50% del total) debido a la baja afinidad que tiene la albúmina por dicha hormona.
Estas hormonas son metabolizadas por dos vías. Una que cambia su actividad como por ejemplo el paso de testosterona a 5-dihidrotestosterona (5-DHT), de andrógenos a estrógenos o de estradiol a estrona (o viceversa). La otra para inactivarlos o disminuir dicha actividad. En esta última vía participa el hígado, el cual solubiliza estas moléculas para facilitar su excreción biliar y urinaria. Así por ejemplo el paso de estradiol a estriol supone reducir su actividad en 20 veces (los valores de estriol suben durante el embarazo). Los niveles de estriol después de la menopausia son bastante constantes.
ESTRÓGENOS. MECANISMO DE ACCIÓN.
Los receptores para estas hormonas pertenecen a la superfamilia de receptores para los esteroides hormonales (tipo I).(Figura 6)
Figura 6: Mecanismo de acción de los estrógenos.
En la actualidad se conocen dos tipos de receptores para el estradiol que se denominan como alfa y beta (ERalfa y ERbeta), cuya localización es diferentes en los tejidos diana y así su acción. Estos receptores también son afines por otras moléculas similares al estradiol.
Los ERalfa se encuentran en ÚTERO, TESTÍCULOS, HIPÓFISIS, RIÑÓN, EPIDÍDIMO, SUPRARRENALES, mientras que los beta se localizan en OVARIO, PRÓSTATA, PULMONES, VEJIGA, CEREBRO Y HUESO.
La acción de estos receptores intracelulares es común al resto en el sentido que trabajan al nivel genómico activando e inhibiendo la transcripción de diferentes proteínas.
También se especula con la posibilidad de que existan receptores de membrana para estas hormonas, dada la rapidez de algunos de sus efectos celulares (sobre todo en el sistema nervioso).
ACCIONES ESTRADIOL
ESTRADIOL (figura 7): Actúa como una hormona de crecimiento en los tejidos reproductivos.
Figura 7: Acciones del estradiol.
Acciones en el desarrollo folicular:
– maduración de los folículos reclutados por la FSH
– preparación del útero, oviducto y vagina para la recepción, transporte y capacitación del esperma.
– incremento del número y tamaño de las células endometriales,
– incremento del número y longitud de las glándulas endometriales,
– incremento de la actividad contráctil del músculo liso uterino,
– incremento de la secreción mucosa del cérvix uterino,
– incremento de la actividad contráctil del músculo liso longitudinal y radial del oviducto
– incremento de la actividad de las células secretoras y ciliadas del oviducto,
– engrosamiento de la mucosa a expensas de la cornificación del epitelio superficial y del aumento de la actividad mitótica de las capas epiteliales basales,
– incremento del glucógeno almacenado que, por acción bacteriana, se transforma en lactato que acidifica el medio,
– estímulo del desarrollo y secreción de la glándula de Bartolino que proporciona una secreción vaginal lubricante durante el coito.
– incrementa el nº de receptores a la LH en las células granulosas y facilitan la acción de la FSH
– acción mitogénica en células granulares.
OTRAS ACCIONES:
– A concentraciones moderadas inhibe la secreción de FSH; a concentraciones altas estimula la secreción de FSH y LH.
– Regulan la actividad de otras hormonas, por incrementar la síntesis hepática de proteínas transportadoras.
– Incrementa la actividad hepática.
– Producen vasodilatación y favorecen el flujo coronario (Collins et al., 1995[7]Collins P, Rosano GM, Sarrel PM, Ulrich L, Adamopoulos S, Beale CM, McNeill JG, Poole-Wilson PA. (1995). 17 beta-Estradiol attenuates acetylcholine-induced coronary arterial constriction in women but not men with coronary heart disease. Circulation. 92(1):24-30.).
– Estimula el desarrollo del sistema tubular mamario que junto con la progesterona estimula el desarrollo del componente alveolar.
– Está implicada en la conducta sexual, incrementando la libido.
– Su disminución favorece la osteoporosis y osteopenia (también en el hombre) (Carani et al., 1997 [8]Carani C, Qin K, Simoni M, Faustini-Fustini M, Serpente S, Boyd J, Korach KS, Simpson ER. (1997). Effect of Testosterone and Estradiol in a Man with Aromatase Deficiency. New England Journal of Medicine Volume 337:91-95.).
– Juega un importante papel en la salud mental de la mujer afectando a su humor y bienestar. La disminución de sus niveles lleva a caídas en el humor, así como alteraciones depresivas relacionadas con la menopausia o el postparto (Douma et al., 2005[9]Douma SL, Husband C, O’Donnell ME, Barwin BN, Woodend AK (2005). "Estrogen-related mood disorders: reproductive life cycle factors". ANS Adv Nurs Sci 28 (4): 364–75.); Lasiuk et al., 2007[10]Lasiuk GC, Hegadoren KM (October 2007). "The effects of estradiol on central serotonergic systems and its relationship to mood in women". Biol Res Nurs 9 (2): 147–60.).
– Probable papel en el ser humano, en el dimorfismo sexual cerebral (Simerly, 2002[11]Simerly, Richard B. (2002). "Wired for reproduction: organization and development of sexually dimorphic circuits in the mammalian forebrain". Annual Rev. Neurosci. 25: 507–536. [Texto completo].; Hulshoff et al., 2006[12]Hulshoff, Cohen-Kettenis et al. (July 2006). "Changing your sex changes your brain: influences of testosterone and estrogen on adult human brain structure". European Journal of Endocrinology 155 (155): 107–114. [Texto completo]).
- En el hombre parece que previene la apoptosis de las células germinales (Pentikäinen et al., 2006[13]Pentikäinen V, Erkkilä K, Suomalainen L, Parvinen M, Dunkel L. ( 2006) Estradiol Acts as a Germ Cell Survival Factor in the Human Testis in vitro. The Journal of Clinical Endocrinology & Metabolism. 85:2057-67.). También hay pruebas de que el incremento del estradiol ambiental disminuye la cantidad de esperma (Sharpe & Skakkebaek, 1993.[14]Sharpe RM, Skakkebaek NE. (1993). Are oestrogens involved in falling sperm counts and disorders of the male reproductive tract? Lancet. 341(8857):1392-5..
Acciones sobre el desarrollo de los caracteres sexuales secundarios: junto con andrógenos y progesterona
– estimulan el crecimiento y desarrollo de las glándulas mamarias,
– estimulan el crecimiento óseo y aceleran el cierre epifisario,
– disminuyen la temperatura corporal,
– favorecen la fijación del calcio en el hueso,
– provocan retención de agua y estimulan el anabolismo proteico,
– favorecen la vasodilatación,
– estimulan el desarrollo gonadal,
– participan en el desarrollo y distribución (junto con la GH y T3) de la grasa subcutánea, dando lugar al fenotipo femenino,
– participan en la morfogénesis de la cavidad pelviana,
– participan en el desarrollo capilar femenino característico,
– participa en el desarrollo del vello púbico en escudo, etc.
ACCIONES PROGESTERONA
PROGESTERONA (figura 8):
Figura 8: Acciones de la progesterona.
Prepara al útero para la fecundación y gestación,
Ejerce un efecto inhibidor específico del crecimiento endometrial,
Convierte al endometrio en estructura secretora,
Convierte el moco fluido en viscoso y espeso,
Tiene efecto miorrelajante en la motilidad uterina,
Al nivel digestivo, su efecto miorrelajante puede dar lugar a diarrea,
Así mismo la miorrelajación genera sensación de cansancio y somnolencia.
Regula la secreción gonadotrópica,
- Incrementa la temperatura central (función termogénica) durante la ovulación.38
Actúa como antagonista de la aldosterona, por lo que produce pérdida de sodio y líquido con disminución de la presión arterial.
La progesterona como neuroesteroide. Como la pregnenolona y dehidroepiandrosterona, pertenece al grupo de neuroesteroides. Puede ser sintetizado dentro del sistema nervioso central y también sirve como un precursor de otro importante neuroesteroide, la alopregnanolona. La progesterona afecta la regulación de los genes apoptóticos. Sus efectos como neuroesteroide funcionan predominantemente a través de la vía beta GSK-3, como un inhibidor.
Otros efectos
- Eleva los niveles del factor de crecimiento epidérmico, un factor que a menudo es utilizado para inducir la proliferación, y se utiliza para mantener los cultivos de células madre.
- Reduce espasmos y relaja los músculos lisos. Los bronquios se amplían y la mucosa es regulada. (Los receptores de progesterona están ampliamente presentes en el tejido submucoso.)
- Actúa como agente antiinflamatorio y regula la respuesta inmune.
- Reduce la actividad de la vesícula biliar[15]Hould FS, Fried GM, Fazekas AG, Tremblay S, Mersereau WA (1988). «Progesterone receptors regulate gallbladder motility». J. Surg. Res. 45 (6): 505-12.
- Tiene efectos catabólicos en el metabolismo de las proteínas,
- Puede que afecte la salud de las encías, aumentando el riesgo de gingivitis y caries dentales.
- Parece evitar el cáncer de endometrio al regular los efectos del estrógeno.
ACCIONES ESTRIOL
ESTRIOL:
Los niveles de estriol en sangre u orina de mujeres embarazadas pueden utilizarse como marcador del buen estado de salud y bienestar del feto, aunque ciertas patologías (preeclampsia, anemia, disfunción renal) pueden desviar dichos valores. Se ha comprobado que el uso de estriol en mujeres con esclerosis múltiple reduce sus síntomas.(Sicotte et al., 2002[16]Sicotte NL, Liva SM, Klutch R, et al. (October 2002). "Treatment of multiple sclerosis with the pregnancy hormone estriol". Ann. Neurol. 52 (4): 421–8. [Texto completo]).
ESTRÓGENOS. REGULACIÓN Y CICLO OVÁRICO.
La regulación (figura 9) en la secreción de esteroides femeninos se realiza en diferentes niveles de su eje endocrino y son consecuencia del juego cíclico de hormonas sexuales. El nivel superior o hipotalámico está bajo la influencia del influjo central bien por estrés, bien por el sistema límbico, corteza, etc. La hormona liberada es la GnRH (LHRH) (decapéptido sintetizado en los núcleos ventromedial y arqueado) cuya secreción pulsátil es la responsable de la síntesis y liberación de las gonadotropinas adenohipofisarias en la etapa fértil de la mujer. Desde poco después del nacimiento hasta el comienzo de la pubertad se encuentra silente. Su aparición en plasma marca el comienzo de la pubertad y actualmente se sabe que es otra señal peptídica, la KISSPEPTINA[17]A finales de los 90 se reportó la existencia de un péptido de 121 aa, el KISSPÉPTINA (del gen Kiss-1), de origen nervioso que interactúa con el receptor GPR54 (similar al receptor de Galanina) existente entre otros sitios, en las células productoras de GnRH (2003). Este péptido pertenece a una familia de péptidos denominados KISS y se considera responsable de la señal de inicio de la pubertad. Sujetos que no tienen … Continúe leyendo, la que inicia el proceso actuando sobre las neuronas secretoras de GnRH y sigue después controlando toda la etapa fértil de la mujer. De la kisspeptina deriva la METASTINA (supresor metastático que se liga al receptor GPR54) o kisspeptina-54, con 54 aa (los primeros 54 aa de la kisspeptina) y parece tener también, un importante papel en la activación de la pubertad. Además, se encuentra en altos niveles plasmáticos durante el embarazo. También nos encontramos con la kisspeptina 14, 13 y 10. Además de su origen hipotalámico, también se encuentra en la placenta. En la mujer procede del núcleo arqueado y área preóptica del hipotálamo. La señal de su activación, es la leptina del tejido adiposo que indica el nivel adecuado de reserva grasa en el sujeto.
Figura 9: Regulación de la secreción de los estrógenos.
Durante prácticamente todo el ciclo el estradiol inhibe, a este nivel, la producción de GnRH, excepto en la fase folicular tardía donde el alto nivel de estradiol ejerce un efecto positivo temporal pero muy fuerte sobre la secreción pulsátil de GnRH, aumentando su frecuencia, mientras que la progesterona y testosterona los disminuyen. Cuando disminuyen las dos: estradiol y progesterona, al final del ciclo, aumentan la frecuencia de los pulsos. Hay indicios de que las catecolaminas al nivel hipotalámico aumentan la frecuencia de los pulsos, mientras que los opiáceos reducen dicha frecuencia. Como se determinan los pulsos aún no se sabe.
Al nivel adenohipofisario el estradiol también ejerce un efecto inhibidor en la síntesis y liberación sobre todo de LH, ya que la FSH está también bajo la influencia de la inhibina y activina ovárica. Excepto cuando sus valores son muy altos (fase tardía folicular) donde activa a las células gonadotrópicas y aumenta el número de receptores de éstas para la GnRH.
La relación LH/FSH varía según los pulsos de GnRH, de forma que si son rápidos aumenta, disminuyendo si son lentos. Por otro lado los estrógenos la aumentan y la progesterona la disminuyen, e igualmente con la disminución de inhibina. Esta relación es menor de uno al comienzo del ciclo y alcanza un 2 poco antes de la ovulación.
En definitiva, el estradiol ejerce un efecto inhibidor a todos los niveles durante todo el ciclo excepto antes de la ovulación, donde alcanza los valores más altos que revierten su acción inhibitoria. Por otra parte la progesterona en las concentraciones de la fase lútea inhibe las secreciones de las gonadotropinas. Cuando el cuerpo lúteo degenera deja de producir progesterona y estradiol y comienza a subir los valores plasmáticos de la FSH (al desaparecer el efecto inhibidor).
Las células de la granulosa foliculares y en las células luteicas se produce la inhibina A (péptido heterodímero de de 32 kD y dos subunidades alfa y beta y puentes disulfuro entre ellas), cuyo papel es inhibir la secreción de la FSH. Esta inhibina presenta modificaciones en el plasma de acuerdo con la fase del ciclo ovárico, aumentando con el número de folículos grandes activos.
Por otro lado, estos folículos también producen activina (homodímero de cadenas beta de la inhibina, presentes en varios formatos), cuyo papel es estimular la síntesis y liberación de la FSH. En la fase inicial del ciclo ovárico hay más activina que inhibina, decreciendo con el aumento del tamaño folicular. Además de ésta, también se encuentra otra molécula hormonal denominada folistatina (proteína monocatenaria presente en dos formas de 31 y 39 kD), la cual liga a la activina, disminuyendo su acción (Robertson, 1992[18]Robertson DM (1992). "Follistatin/activin-binding protein". TEM 3:65-68..
In vitro, el agregado de T4 a cultivos de células de la granulosa humana confirma el aumento de producción de procesos energéticos (evaluados a través de la concentración de AMP cíclico) y de esteroides por el aumento de progesterona. En presencia de FSH, aumenta la producción de estradiol en relación al efecto de la FSH sola. Esto corrobora el papel modulador de la hormona tiroidea sobre la actividad esteroidea gonadal y por extensión sobre la foliculogénesis ovárica con un claro determinismo sobre la capacidad reproductiva de la mujer.
La interacción estrógenos-tiroides es fundamental para ambos ejes, el tiroideo y el gonadal, y condicionante de mantener la potencialidad reproductiva normal. Así, resulta comprensible la disfunción ovárica y la infertilidad de las pacientes con alteraciones tiroideas íntimamente relacionadas con el fracaso del desarrollo y maduración folicular que presentan estas mujeres. La disfunción tiroidea puede manifestarse con cualquier tipo de alteración del ciclo como oligomenorrea, polimenorrea, metrorragia o amenorrea[19]Winters S, Berga S. Gonadal dysfunction in patients with thyroid disorders. The endocrinologist 1997; 7: 167-173..
El aumento de estrógenos de causa fisiológica como en el embarazo o iatrogénico/patológico como en las pacientes con tratamiento sustitutivo o contraceptivo, induce un aumento en la TBG lo que supone un descenso de hormonas tiroideas libres, es decir activa. Este aumento estrogénico también lleva a una hiper respuesta del eje tiroideo a la TRH con un incremento de la secreción de TSH. Esto puede evidenciarse en la etapa peri ovulatoria donde se registra una mayor respuesta al TRH por la célula tirotrófica hipofisaria.
En los hipogonadismos severos con estados hipoestrogénicos graves, se han descrito hipotiroidismos consecuentes con el estado de base.
La TRH hipotalámica actúa como un neuromodulador de la secreción gonadotrófica estimulando fundamentalmente la secreción hipofisaria de LH. En los casos de hipotiroidismo[20]Arojoki M, Jokimaa V. Hypothyroidism among infertile women in Finland. Gynecol Endocrinol 2000 April; 14 (2): 127-31. se demostró una disminución en la frecuencia de los pulsos de FSH y LH con un aumento en su amplitud.
Sobre el ovario, se detectaron receptores específicos para hormonas tiroideas lo que explica mejor los mecanismos moduladores de estas hormonas sobre las funciones del ovario. La T3 estimula la proliferación celular y la cantidad de AMP cíclico teniendo una acción sinérgica con la FSH contribuyendo a amplificar su acción en las células inmaduras y favoreciendo su crecimiento y diferenciación.
Se ha comprobado la relación entre la concentración de la T4 en plasma y en el líquido folicular. La acción de la T4 sobre los factores de crecimiento ovárico (IGF) constituye un factor complementario de influencia de la glándula tiroides sobre el ciclo ovárico. En las pacientes hipotiroideas se ha confirmado la disminución tanto de IGF-1 como de la síntesis hepáticas de las proteínas de transporte conocidas como IGF-Bp. La T4 interactúa con las IGF y potencia la acción de la FSH, coadyuvando en la aromatización de andrógenos a estrógenos[21]Raggatt L, Blok R, Hamblin S, Barlow J. Effect of thyroid Hormone on sex hormone-binding globulin gene expression in human cells. J Clin Endocrinol Metab 75: 116-120, 1992..
CICLO OVÁRICO
Tiene como objetivo facilitar la fecundación de, al menos, una célula germinal (óvulo), para lo cual se ponen en juego la interacción cíclica de diferentes hormonas.
El ciclo comienza el primer día del sangrado menstrual y tiene una duración media de 28 días. El origen del mismo no está muy claro y hay evidencias de que puede ser de origen ovárico y no nervioso. De hecho, es el incremento excesivo de estradiol folicular, en el folículo preovulatorio maduro, el que provoca el pulso de LH y la ovulación, dependiente de los días necesarios para la maduración de dicho folículo. Aunque también es verdad que fuertes estímulos de origen nervioso pueden alterar los pulsos secretorios de GnRH y consecuentemente los de las gonadotropinas y parar o alterar el ciclo. Igualmente ocurre con otros factores hormonales, como cortisol, andrógenos y T3/T4.
En condiciones normales se inicia con el comienzo del sangrado menstrual que coincide con una disminución drástica de los niveles de progesterona y estradiol y subida de FSH. Fase folicular (duración 13 días).
Los niveles de FSH al comienzo del ciclo son ligeramente más altos que al final de la fase folicular. Este ligero incremento de FSH hace que maduren algunos folículos y empiecen a producir estrógenos de forma progresiva, que ejercen un efecto inhibidor sobre la liberación de las gonadotropinas y a su vez hacen a las células foliculares más sensibles a éstas. La FSH también aumenta el número de receptores en las células granulosas para la propia hormona. Este incremento de receptores hace a las células granulosas más sensibles a dicha hormona a pesar de que sus niveles no son muy altos en el plasma. Al final de esta fase tanto el estradiol como la FSH incrementan también los receptores para la LH tanto en las células de la teca como en las granulosas. El incremento final, es esta fase, del estradiol ejerce un efecto positivo sobre la liberación adenohipofisaria tanto de FSH como de LH (hace más sensibles a la adenohipófisis a la acción de la GnRH, y lleva al pico de LH y a la ovulación. Este pico comienza 24 horas antes de la ovulación y alcanza el máximo unas 16 horas antes de la ovulación. También hay un pico, pero algo menor, de FSH que algunos piensan que sirve para activar a los nuevos folículos del siguiente ciclo.
Estos valores altos de estradiol determinan también cambios en los tejidos reproductivos (endometrio, epitelio cervical y vaginal, trompas) que favorecen la llegada de los espermatozoides, así como modificar la conducta receptiva sexual. El endometrio se encuentra en fase proliferativa celular y vascular, con expresión de receptores para la progesterona.
En la fase lútea el incremento en progesterona además de inhibir a las gonadotropinas determina cambios en el endometrio que favorecen la implantación del ovocito fecundado, disminuye la excitabilidad del miometrio (acción también potenciada por la relaxina del cuerpo lúteo) y la permeabilidad del moco cervical. Los pulsos de LH son más espaciados lo que es necesario para el mantenimiento del cuerpo lúteo. El endometrio entra en fase secretora por sus glándulas uterinas estimuladas por la progesterona. Se vuelve grueso, vascularizado, de aspecto esponjoso y sus glándulas uterinas se llenan de glucógeno, secretando un líquido claro.
Si no hay fecundación, se produce la regresión del cuerpo lúteo en los nueve días siguientes, disminuyendo los niveles de progesterona y estradiol y consecuentemente disminuyendo el efecto inhibidor sobre las gonadotrofinas, especialmente la FSH, las cuales comienzan a incrementar sus niveles en sangre activando nuevamente el reclutamiento folicular y comenzando un nuevo ciclo que coincide con la menstruación o sangrado, debido a la falta de aporte hormonal al endometrio que ha ido desarrollándose durante la fase preovulatoria. Esta falta de aporte hormonal por degeneración del cuerpo lúteo hace que el endometrio adelgace produciéndose la aparición de zonas necróticas que provocan hemorragias, siendo causa del sangrado menstrual (Fase menstrual). Esta necrosis parece ser debida a un aumento local de prostaglandinas F2a, cuya concentración se ve incrementada de forma importante durante este periodo.
Otros cambios generados durante el ciclo son la queratinización del epitelio vaginal por acción del estradiol; la producción de un moco cervical acuoso que se espesa y se hace pegajoso durante la fase luteica.
ALTERACIONES EN LOS ESTRÓGENOS
Los efectos de las alteraciones en los niveles plasmáticos normales de las hormonas sexuales femeninas, dependen de la edad de la mujer.
Figura 11: Alteraciones estrogénicas.
Durante la edad fértil las alteraciones hormonales se reflejan en alteraciones del ciclo ovárico. Estas alteraciones vienen determinadas normalmente por alteraciones nerviosas que afectan al normal funcionamiento del eje hormonal, pero también por trastornos hipotalámicos, hipofisarios, ováricos y enfermedades sistémicas. Se conoce por amenorrea la ausencia de periodos menstruales. Si no se ha presentado nunca, se denomina primaria; si se presenta entre ciclos normales, se denomina secundaria. Esta última ocurre durante el embarazo.
Existe todo un conjunto de alteraciones del ciclo o que acompañan a éste como la hipomenorrea y menorragia referidos a la disminución o aumento del flujo; la metrorragia, sangrado del útero entre periodos; oligomenorrea o disminución de la frecuencia de los periodos; la disminorrea o menstruación dolorosa (con aumento de prostaglandinas en el útero como causa).
El síndrome premenstrual son un conjunto de alteraciones que en algunas mujeres se manifiestan durante los últimos 7 a 10 días. Irritabilidad, flatulencia, edema, labilidad emocional, disminución de la capacidad de concentración, depresión, cefalea y estreñimiento, son las manifestaciones más comunes de dicho síndrome. Los agonistas de la liberación de GnRH en dosis supresoras del eje hipófisis-ovario, producen un alivio sintomático, así como algunos antidepresivos como la fluoxetina (Prozac) (inhibidor de la recaptación de serotonina).
Por alteraciones genéticas aparecen anomalías reproductivas en las mujeres. Por disminución de gonadotropinas (hipogonadismo hipogonadotrópico) (síndrome de Kallman); por resistencia a la GnRH , LH y FSH; o por deficiencia en aromatasa.
Hay tumores dependientes de estrógenos como el carcinoma de mama. Sus síntomas se alivian con la disminución drástica de estrógenos en plasma, aunque el cáncer no desaparece. En casos extremos no solo es necesario eliminar los ovarios, sino también las suprarrenales como origen de andrógenos aromatizables. E incluso regular la proporción de tejido graso para disminuir la aromatización que se realiza en éste. La hipofisectomía también puede ser realiza no solo para disminuir las gonadotropinas sino para disminuir la GH y la PRL , hormonas que estimulan el crecimiento de los carcinomas mamarios.
ENLACES DEL TEMA EN LA WEB
Medline Plus Medical Encyclopedia (estrógenos)
Medline Plus Medical Encyclopedia (progesterona
Wikipedia (estrógenos)
Wikipedia (progesterona)
Información Medline Plus Medical sobre estrógenos
Medida en suero de estradiol
Progesterona sérica
Medida en sangre de FSH
Medida en sangre de LH
17-cetosteroides en una muestra de orina
Anticoncepción
Las hormonas del ciclo reproductivo femenino
Método de la Ovulación Billings
VIDEOS EN YOUTUBE
Vídeo: Hormonas, cerebro, pubertad
Vídeo: testosterona y competitividad: diferencias de género
PATOLOGÍA
Patologías relacionados con las hormonas femeninas
Síndrome ovárico poliquístico
Amenorrea
BIBLIOGRAFÍA GENERAL
S. Constantin. (2011) Physiology of the GnRH neuron: Studies from embryonic GnRH neurons. Journal of Neuroendocrinology
FISIOLOGIA / SISTEMA ENDOCRINO / EJE HORMONAL SEXUAL FEMENINO/ ESTRÓGENOS OVÁRICOS
![]()














 Views Today : 170
Views Today : 170 Views This Month : 15269
Views This Month : 15269 Views This Year : 30047
Views This Year : 30047 Total views : 399194
Total views : 399194