Ingrese su ID de correo electrónico
FISIOLOGIA. / SISTEMA NERVIOSO/ CIRCULACIÓN CEREBRAL. BARRERA HEMTOENCEFÁLICA
CIRCULACIÓN CEREBRAL. BARRERA HEMATOENCEFÁLICA
TABLA DE CONTENIDO
- Objetivos
- Introducción
Circulación cerebral
- Aspectos morfo funcionales
- Flujo sanguíneo cerebral
- Distribución
- Regulación del flujo sanguíneo cerebral. Autorregulación y factores
- Barrera hemato-LIT
- Barrera hemato-LCR
- Barrera LCR-LEC
- Funciones de la BHE
- Producción, composición, circulación, absorción (dependencia de la presión intracraneal)
- Fisiopatología de la BHE, LCR y CC
- Referencias
OBJETIVOS
- Conocer las características morfo funcionales de la circulación cerebral.
- Conocer el flujo sanguíneo cerebral, su cuantía y distribución y el por qué de la dependencia cerebral del mismo.
- Conocer y describir los factores determinantes del flujo sanguíneo cerebral.
- Describir cómo se regula el flujo sanguíneo cerebral.
- Describir la formación y reabsorción del LCR incluyendo la anatomía y función de los plexos coroideos.
- Escribir las cifras normales de presión, volumen y composición del LCR y describir sus cambios fundamentales en condiciones patológicas.
- Describir las bases endoteliales de la barrera hematoencefálica y discutir sus consecuencias en cuanto a la distribución en el Sistema Nervioso Central (SNC) de drogas hidrofóbicas o hidrofílicas administradas
INTRODUCCIÓN
En la figura (figura 1) se representa el esquema y los elementos que nos permiten introducir el tema. En esta representación esquemática del encéfalo apreciamos de fuera hacia dentro como primer elemento el CRÁNEO, estructura ósea y rígida que además de proteger a la masa encefálica de traumatismos externos, permite mantener la diferencia de presión entre la presión atmosférica y la presión vascular intracerebral, que en el sujeto en posición vertical es menor que la atmosférica.
Figura 1: Barrera hematoencefálica. Introducción.
Luego encontramos el PARÉNQUIMA formado por las células cerebrales (neuronas y glia) y los líquidos característicos (extracelular (intersticial) y cefalorraquídeo (LCR)). Los VENTRÍCULOS, espacios huecos llenos de LCR con diferentes funciones, como amortiguadora, de drenaje, sustentación y comunicación. Por último, la CIRCULACIÓN CEREBRAL, que por encontrarse encerrada en una estructura rígida, tiene ciertas particularidades hemodinámicas, además de presentar una autorregulación que le permite asegurar un flujo adecuado a las importantes necesidades metabólicas cerebrales independientemente a los cambios de la presión arterial sistémica.
Hoyer y otros autores han comprobado desde hace dos décadas, que el cerebro, en condiciones normales, sólo oxida glucosa para obtener la energía necesaria que satisfaga su demanda estructural y funcional (salvo en ayuno prolongado y en situación de cetosis) (figura 2). En el cerebro adulto, el ratio de consumo de oxígeno (20% de todo el oxígeno consumido en el organismo) y glucosa se halla en equilibrio para mantener su alto metabolismo (con una capacidad limitada para la glucólisis anaeróbica) con un CR (cociente respiratorio) de 0,95 a 0,99[1] Transportador tipo I para la glucosa en el endotelio vascular cerebral, independiente de la insulina (similar al de los eritrocitos). Ambos productos (O2 y glucosa) son utilizados de manera constante para restaurar los almacenes del trifosfato de adenosina utilizados por las bombas iónicas dependientes, las cuales son requeridas para mantener la distribución compartimental de iones tales como el sodio, potasio, calcio, hidrógeno y bicarbonato.
Figura 2: Circulación cerebral. Consumo de oxígeno y glucosa.
Los requerimientos metabólicos y el flujo sanguíneo cerebral suelen correlacionarse (figura 3), de tal manera que un incremento de la necesidad de energía se acompaña normalmente de un aumento del flujo sanguíneo, mientras que una reducción conduce a una atenuación del flujo sanguíneo cerebral. En varias especies animales, incluido el hombre, se ha visto que alteraciones en el sistema de flujo cerebrovascular (FSC) producen una disfunción paralela en la actividad neuronal. El cerebro no soporta más de 5 segundos con el flujo interrumpido, más por la hipoxia que por la hipoglucemia.
Figura 3: Circulación cerebral. Flujo cerebral.
Por otra parte, el sistema nervioso central (SNC) es muy sensible a los cambios iónicos y metabólicos que se generen en su entorno inmediato, ya que éstos afectan al metabolismo y la actividad eléctrica de sus neuronas[2]Mírese el efecto que sobre la excitabilidad neuronal ocasionaría un aumento o disminución de la concentración extracelular de potasio. O la rápida renovación de los neurotransmisores utilizados. por lo tanto, su medio interno (figura 4) debe tener características muy especiales para evitar alteraciones en el funcionamiento normal de las mismas e importantes mecanismos de regulación y control.
Figura 4: Circulación cerebral. Medio interno cerebral.
Este medio interno (figura 5), representado por un equilibrio entre los líquidos propios cerebrales (líquido intersticial (LIT) y líquido cefalorraquídeo (LCR)), sus solutos y las propiedades físico-químicas que los caracterizan, actúa además como soporte estructural del tejido nervioso.
Figura 5: Circulación cerebral. Medio interno cerebral.
Para conservar y regular las características del medio interno del SNC se crea una barrera físico-química selectiva en los dos sentidos entre la circulación sanguínea que riega al SNC y el propio SNC, la BARRERA HEMATOENCEFÁLICA (BHE) (figura 6) [3]Se puso de manifiesto en 1910 por E. Goldmann en el laboratorio de Paul Ehrlich, al inyectar en ratones una solución de azul de trípano. En las autopsias se observó que todos los tejidos se coloraban de azul excepto la mayor parte del SNC, nervios periféricos, ojos, oído interno y partes del.

Figura 6: Circulación cerebral. Barrera hematoencefálica.
Luego son dos los elementos esenciales que garantizan el buen funcionamiento del encéfalo (figura 7):
Figura 7: Circulación cerebral. Barrera hematoencefálica. Requisitos.
- El adecuado FLUJO SANGUÍNEO, que depende de un fino control de la Circulación Cerebral, y
- La presencia de una BARRERA HEMATOENCEFÁLICA, que asegure el Medio Interno especial que requiere el sistema nervioso central.
ASPECTOS MORFO FUNCIONALES DE LA CIRCULACIÓN CEREBRAL
La sangre arterial que riega al cerebro procede (figura 8), en su mayor parte, de las dos carótidas internas y en menor medida de las dos vertebrales que se unen para formar la arteria basilar, que junto con las carótidas internas forman el denominado polígono de Willis, del cual salen los seis grandes vasos arteriales que riegan toda la masa cerebral. En el polígono de Willis no hay prácticamente entrecruzamientos vasculares, por lo que cada carótida se encarga de suministrar sangre a la región cerebral ipsilateral.
Figura 8: Principales troncos arteriales del cerebro.
FLUJO SANGUÍNEO CEREBRAL. DISTRIBUCIÓN
Medido según el principio de Fick (cantidad de una sustancia captada por el cerebro en la unidad de tiempo, dividido por la diferencia arteriovenosa de la misma) (Figura 9) y utilizando el N2O (método de Kety y Schmidt, 1945[4]) Inhalando oxido nitroso en cantidades subanestésicas es captado por el encéfalo y equilibrado con la sangre en unos 10 minutos. Así, la [N2O]V / [N2O]a - [N2O]v = FSC por unidad de encéfalo.)como indicador, da un valor de entre 50 y 60 ml/100 g/min para el joven adulto. Teniendo en cuenta que el peso del encéfalo adulto es de unos 1400 gramos, el flujo total es de unos entre 700 y 840 ml/min. ( 14 a 17% del gasto cardiaco).
Figura 9: Medida del flujo sanguíneo cerebral. Método de Fick.
VALORES DEL FLUJO SANGUÍNEO CEREBRAL
DISTRIBUCIÓN
Para medir la distribución encefálica de este flujo (Figura 10) , se utiliza el 133Xe (entre otros) y una batería de detectores de centelleo (254) en la cabeza. De esta forma y junto con técnicas de tomografía y resonancia magnética obtenemos los flujos regionales[5]Otro método es utilizando la captación local de 2-desoxiglucosa marcada con F18, O11, O15 mediante tomografía computarizada por emisión de fotón único (SPECT) y la tomografía por emisión de positrones (PET). Nos permiten mapas funcionales del cerebro..
Flujo medio hemisférico: 48 ml/100 g/min
Flujo medio sustancia gris: 69 ml/100 g/min
Flujo medio sustancia blanca: 28 ml/100 g/min
Interesante es ver la distribución del flujo en distintos estados cerebrales.
En el ser humano, el umbral de flujo sanguíneo requerido para la transmisión sináptica es de aproximadamente 20 a 25 cc/100g/min. Por debajo de ese nivel, ocurre silencio eléctrico y dependiendo de la localización del sitio afectado se instala un déficit funcional.
Los estudios en animales han demostrado que la lesión neuronal irreversible con déficit neurológico clínico ocurre a flujos sanguíneos cerebrales (FSC) que oscilan entre 18 y 23 ml/100 g/min. El «tiempo» también juega un papel crítico en la determinación de la viabilidad tisular dentro de la penumbra isquémica. A FSC de 23 ml/100 g/min, la depleción del ATP ocurre en seis horas; sin embargo, a FSC de 13 ml/100 g/min, la depleción del ATP ocurre en tan solo 30 minutos. De tal manera que existe un substrato fisiológico claro para la penumbra isquémica.
FACTORES QUE DETERMINAN EL FLUJO SANGUÍNEO CEREBRAL
LA PPC ( presión de perfusión cerebral) resulta de la diferencia entre la presión intra arterial (PAM)[6]La presión arterial media en el cerebro es de unos 62 mmHg para una presión arterial media sistémica de 100 (100 mmHg – (0,77 mmHg/cm x 50 cm )) en posición vertical. conforme los vasos penetran el espacio subaracnoideo y la presión en las venas de paredes delgadas, justo antes de su entrada hacia los senos durales más rígidos. Y esta última depende de la presión intracraneal (PIC) (Figura 11).
Figura 11: Factores que determinan el flujo sanguíneo cerebral.
La presión intracraneal aparece como la presión que ejerce el volumen tanto del parénquima encefálico (1400 gr) como del líquido cerebral (LCR) (150 ml) y la sangre que circula (60 ml).
El parénquima y el LCR son volúmenes no comprimibles dentro de una estructura rígida que es el cráneo (Figura 12). Al no ser comprimibles estos volúmenes, el único elemento comprimible que queda son los vasos sanguíneos y de éstos los más proclives a ello, son los vasos venosos. Cuando aumenta la PIC se comprimen los vasos venosos y disminuye el FSC. Si la PIC es mayor de 33 mmHg el FSC cae significativamente generando isquemia cerebral lo que activa el centro vasomotor, provocando un incremento de la PAM con bradicardia y respiración lenta (reflejo de Cushing)[7]Ante una aceleración positiva (hacia arriba) se produce un movimiento de la sangre hacía los pies, disminuyendo la presión arterial cerebral que pondría en peligro su riego (la perfusión). Sin embargo, la presión venosa también disminuye por lo que se mantiene el gradiente de presión efectiva o PPC, y así, el FSC. Además diminuye la PIC no afectándose el calibre de los vasos cerebrales. . (Figura 12)
Figura 12: Reflejo de Cushing.
Existe una proporcionalidad directa entre el incremento de la PIC y el de la PAM , hasta que la PIC se hace mayor que la PAM y cesa el FSC.
Luego cualquier cambio en una de estas dos afecta al cambio de la PPC y por tanto del FSC. Además de esta dependencia entre los cambios de PIC y PAM se observa una cierta independencia de la hemodinámica cerebral con respecto a los cambios en la presión arterial media sistémica, de forma que frente a cambios de ésta de entre 60 y 160 mmHg el FSC se mantiene más o menos constante (más preciso en el tronco del encéfalo). Por debajo de 60 el FSC disminuye y se produce un síncope; y por encima de 160 aumenta la permeabilidad de la BHE y se produce edema cerebral. Esta constancia supone una potente autorregulación dentro del cerebro.
Un cambio en el volumen de uno de ellos debe ser compensado por un cambio proporcional en los otros. Por tanto, si aumenta el flujo arterial cerebral debe aumentar el flujo venoso cerebral y viceversa (Figura 13).
Figura 13: Efectos del cambio de volumen sanguíneo en el cerebro.
AUTORREGULACIÓN
Es una propiedad de algunos órganos por la que se mantiene el flujo sanguíneo lo más constante posible dentro de un rango de cambios de presión arterial media. En el cerebro este rango está entre 60 y 160 mmHg. (Figura 14)
Figura 14: Autorregulación del flujo sanguíneo cerebral.
¿Cómo se consigue?: regulando la resistencia[8]La resistencia vascular cerebral es de 10 UR/kg cerebro o 7,2 UR/encéfalo entero. de las arteriolas cerebrales, para lo que hay propuestos varios mecanismos, aunque todos ellos son proporcionados por el propio cerebro, es decir, son mecanismos internos (Figura 15).
Figura 15: Factores que intervienen en la autorregulación del flujo cerebral.
Primeramente tenemos que contar con las propiedades miogénicas del músculo liso vascular cerebral frente al incremento del FSC como respuesta muscular a la distensión (incrementos de presión).
Los factores locales de tipo metabólico son los responsables de la respuesta vasodilatadora frente a caídas del FSC.
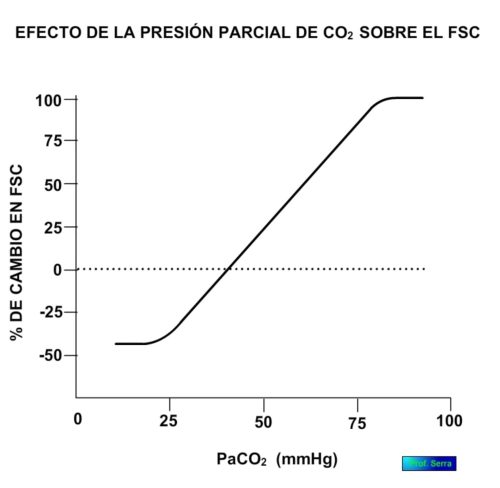
Entre los factores vasodilatadores propuestos tenemos el NO y la adenosina y el potasio extracelular, como responsables de las variaciones regionales del flujo. Pero el más importante es la PCO 2 cerebral (Figura 16), de forma que cuando ésta aumenta lo hace rápidamente el FSC[9] La inhalación de CO2 al 7% duplica el FSC. . El mecanismo es explicado por los cambios en el pH tanto perivascular como intracelular de las células musculares vasculares, que afecta a su estado de contracción y por tanto, a la resistencia arteriolar.
Figura 16: Efecto de la PCO2 en el flujo sanguíneo cerebral.
También se observa que la PO 2 cerebral (Figura 17) ejerce efectos reguladores del calibre de los vasos cerebrales, de forma que una disminución en dicha presión genera una ligera vasodilatación.
Figura 17: Efecto de la PO2 en el flujo sanguíneo cerebral.
Por último, el papel neurogénico regulador externo de la resistencia vascular cerebral es variable según la actividad del sujeto. Cuando el sujeto realiza ejercicios fuertes o aumenta la actividad circulatoria general, los vasos cerebrales, que están profusamente inervados por terminaciones simpáticas procedentes del ganglio cervical superior, generan una fuerte constricción en arterias de mayor calibre, evitando un incremento de la presión en las de menor calibre. En condiciones de actividad normal solo genera una ligera vasoconstricción. Sin embargo la desnervación simpática de estos vasos disminuye su capacidad autorreguladora (probablemente por la disminución de un factor trófico endotelial de origen simpático). La inervación vasodilatadora parasimpática que poseen los vasos cerebrales (procedente de los ganglios esfenopalatinos (transmisores: Ach, VIP, PHM-27)) y del trigémino con transmisores como SP, ASP y PRGC) tienen un ligero efecto vasodilatador.
Frente a estados crónicos de hipertensión se produce un fenómeno de adaptación por el cual aumenta la resistencia vascular cerebral y se mantiene el FSC en sus valores normales (Figura 18). Este mecanismo de adaptación viene determinado por la hipertrofia del músculo liso vascular cerebral y por una limitación espacial de la vasodilatación por incremento de este tejido muscular y conjuntivo. El problema está en que cuando se vuelve repentinamente al valor normal de presión arterial, la vascularidad cerebral no responde y se produce una disminución del FSC que lleva a hipoxia y desmayo.
Figura 18: Adaptación del flujo sanguíneo cerebral a la hipertensión vascular.
BARRERA HEMATOENCEFÁLICA
La barrera hematoencefálica (Figura 19) es tanto estructural como funcional y genera según la zona donde se establece, dos tipos de líquidos diferentes aunque en equilibrio: EL LÍQUIDO INTERSTICIAL (LIT), que baña directamente a las células nerviosas (espacio intersticial que supone el 15% del total del tejido) y forma parte del llamado parénquima cerebral (el 80% del contenido intracraneano). Y EL LÍQUIDO CEFALORRAQUÍDEO (LCR) que corresponde al 10% del contenido intracraneano y se encuentra rodeando a todo el SNC y también contenido en los ventrículos cerebrales. Su función principal es facilitar una vía de drenaje de los productos metabólicos cerebrales hacia la circulación sanguínea (es como la “linfa” cerebral). [10]La primera observación de la barrera fue realizada por Paul Ehrlich al final del sigo XIX. Utilizando tintes de anilina observó que el cerebro no se teñía y pensó que el cerebro no absorbía la anilina. Posteriormente, su discipulo Edwin Goldman en 1913, inyectó tinte directamente en el cerebro, en el LCR, observando que el cerebro se teñía pero el resto del organismo no. El concepto de barrera sangre-cerebro, luego denominada hemato-encefálica … Continúe leyendo
Figura 19: Barrera Hematoencefálica.
De acuerdo a los espacios que separa dentro del SN esta BHE puede recibir diferentes nombres (Figura 20):
Figura 20: Tipos de barreras hematoencefálicas.
La barrera entre el capilar sanguíneo y el LIT del SN es la BARRERA HEMATO-LIT. (También llamada HEMATOENCEFÁLICA propiamente)
La barrera entre el capilar sanguíneo y el LCR es la BARRERA HEMATO-LCR (BHLCR).
La barrera entre el LIT del SN y el LCR es la BARRERA LCR-ENCEFÁLICA .
BARRERA HEMATO-LIT (BHE)
Consiste en una monocapa de células endoteliales de los capilares cerebrales, que actúa como reguladora del trasiego de sustancias entre el parénquima cerebral y los capilares. Las células endoteliales del SNC se hallan íntimamente interconectadas por "tight junctions" (uniones estrechas)(sin espacios intercelulares), carecen de fenestración y muestran pocas vesículas pinocitósicas. Estas características estructurales del endotelio vascular cerebral constituyen una barrera selectiva para controlar el paso de sustancias de la sangre al neuropilo. Las células endoteliales conforman la barrera hematoencefálica (BHE). Estas células están rodeadas por la membrana basal que forma un revestimiento continuo de la superficie basal del endotelio, dentro de la cual se hallan inmersos los pericitos[11]Se trata de células de tejido conjuntivo, probablemente contráctiles, que residen fuera de los vasos sanguíneos y envuelven las células endoteliales de los capilares con sus delgadas prolongaciones. Parecen tener una función desintoxicadora. , mientras que la pared vascular externa se halla cubierta por las prolongaciones podálicas de los astrocitos. (85% de la superficie entre ambos) Las sustancias que salen de los capilares tienen que difundir por las células endoteliales o ser transportadas específicamente. (Figura 21)
Figura 21: Barrera cerebral sangre-LIT.
Esta barrera presenta una superficie total mucho mayor que la barrera hemato-LCR.
BARRERA HEMATO-LCR
Se forma entre la sangre de los capilares del plexo coroideo[12]El plexo coroideo está formado por una capa de células epiteliales que rodean a los vasos sanguíneos inmersos en el tejido conectivo, que llegan a esa zona. Estas células ependimarias se encargan de segregar el LCR hacia los ventrículos y son semejantes a las células secretoras de los túbulos renales y otros tejidos glandulares. Los capilares son semejantes a los titulares y muy distintos a los cerebrales de la barrera hemato–LEC. (origen del LCR) y el LCR. También en los vasos del espacio subaracnoideo y en las granulaciones aracnoideas donde se reabsorbe el LCR. (Figura 22)
Figura 22: Barrera hemato-LCR cerebral.
BARRERA LCR–LIT
Las cavidades ventriculares están tapizadas por células del epéndimo (ependimoglia) y astrocitos subependimarios. También en el espacio subaracnoideo interviniendo la pía-aracnoides y células gliales.(Figura 23)
Figura 23: Barrera encefálica LCR-LIT.
Hay ciertas regiones cerebrales llamadas órganos circunventriculares que no tienen BHE (Figura) como el área postrema[13]Su estímulo químico genera el vómito. (pared del cuarto ventrículo), el órgano subfornical[14]Regula la sed, el equilibrio hídrico y la temperatura. (pared anterior del tercer ventrículo) y la eminencia media hipotalámica, la neurohipófisis y la glándula pineal.
FUNCIONES DE LA BHE
La BHE regula el entorno nutritivo y homeostático del SNC. El agua, el CO2 y el O2 pasan con facilidad la barrera. El resto de los solutos requieren más tiempo para equilibrarse con el líquido encefálico[fnEl pH del líquido encefálico es de 7,33 mientras que el de la sangre cerebral es de 7,4. Los iones principales tardan más (entre 3 a 30 veces) en equilibrarse con el LCR. Los ácidos biliares y las catecolaminas prácticamente no entran en el adulto. Las proteínas cruzan de forma muy limitada, etc.] [/fn](puede verse en la gráfica de la composición del LCR). Con base en la estructura y función de las células que forman parte de esta barrera, las sustancias pasan a través de tres mecanismos:
1) rutas extracelulares,
2) difusión plasmalemal, y
3) sistemas selectivos de transporte.
Las rutas extracelulares funcionan mediante el pasaje residual que ocurre en torno a las células ependimales, el espacio subaracnoideo y otros puntos de posible trasvase de sustancias desde el torrente sanguíneo[15]La tasa de paso por esta ruta es muy baja, equivalente a la de la albúmina, con un trasiego unidireccional de sangre a cerebro y una constante de entrada (Ki) de 10- 5 a 10-6 ml/g/min., según demuestran los estudios de William Banks. Esto indica que la cantidad de sustancia que se encuentra en 0.01 a 0.001 ml de plasma entra en un gramo de cerebro cada minuto. .
La segunda ruta, es por difusión a través de membranas y depende fundamentalmente de las características químicas de cada molécula, su liposolubilidad, sus enlaces hidrogenados, su peso molecular, carga iónica, estructura tridimensional, unión a proteínas y capacidad de auto agregación. Las propiedades de la membrana a través de la cual pasan estas sustancias también importa, sobre todo la carga de superficie y la fluidez de la membrana.
La tercera ruta, altamente selectiva, es la de los sistemas de transporte saturables, como el sistema de las hexosas, que transporta la glucosa al interior del cerebro, o los sistemas para aminoácidos neutros, como la tirosina. Estos sistemas permiten el acceso de sustancias específicas al cerebro con una velocidad 10-1000 veces superior a la que les permitirían otros sistemas no saturables. Una de las características de estos sistemas de transporte selectivo es que se autorregulan en función de la demanda metabólica y cambian en el tiempo, desde las fases de desarrollo hasta la senectud. También están influenciados por neurotoxinas, y cualquier defecto de funcionamiento puede conducir a enfermedades del SNC.
Una función recientemente atribuida a la BHE es su capacidad para controlar el intercambio de moléculas activas, como péptidos y proteínas reguladoras, entre el SNC y la circulación periférica. Ejemplos de estas moléculas son la insulina y la leptina que entran en el cerebro a través de la BHE para controlar el apetito y las conductas derivadas; o la metionina-encefalina, que sale del cerebro para controlar las conductas adictivas al alcohol; o también diversas citokinas, que entran y salen del cerebro para regular la red neuroinmune. Algunas células del sistema inmune atraviesan la BHE por diapédesis para ejercer sus funciones lejos de su entorno original. Otros procesos, como la endocitosis adsortiva, que ocurren normalmente o son activados por agentes patógenos, también pueden constituir nuevos mecanismos de trasiego molecular a través de la BHE.
Con la edad se reduce la capacidad de transporte hematoencefálico de aminoácidos neutros, pequeños péptidos tirosinados, colina, glucosa, triptófano y otras sustancias.
El líquido intersticial encefálico forma el 15% del volumen del cerebro, cuya composición puede cambiar transitoriamente de acuerdo con la actividad neuronal. En su regulación participa la neuroglia que entre otras funciones está la de disminuir la concentración extracelular de potasio ocasionada por la actividad neuronal. Este fenómeno se denomina amortiguamiento espacial, creándose una corriente de potasio intraglial provocada por la diferencia de potencial entre la zona de alta concentración de potasio y la normal, compensada con una corriente extracelular inversa de sodio.
LÍQUIDO CEFALORRAQUIDEO
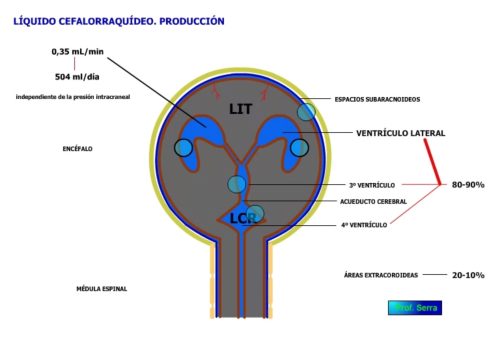
El líquido cefalorraquídeo es un líquido claro (aspecto del cristal de roca) que baña al cerebro y a la médula espinal que circula por los ventrículos cerebrales y el canal medular y se almacena en las cisternas cerebrales. Es producido (Figura 24) en un 80-90% en los plexos coroideos de los cuatro ventrículos cerebrales, sobre todo los laterales y en zonas extracoroideas 10-20%, a razón de 0.35ml/minuto o 500 ml/24 horas (renueva 3,7 veces al día).
Figura 24: LCR. Producción.
Su volumen total en el hombre es de 150 ml ( unos 50 ml intra ventricular) y una presión de 12 a 18 cm de agua ( 8,9 a 13,32 mmHg)(en decúbito) (Figura 25) .
Figura 25: LCR: Volumen y presión.
La composición del LCR (Figura 26) es muy similar a la del LIT encefálico. Equilibrio obtenido gracias a la barrera LCR-LEC, aunque por la distancias de difusión entre ambos líquidos pueden encontrarse diferencias locales. Se encuentran células leucocitarias en cantidades menores de 4-5 /mm3.
Figura 26: Composición del LCR.
Existe una circulación del LCR (Figura 27) desde su origen principal (los ventrículos laterales del cerebro), pasando al 3er ventrículo por el agujero de Monroe. En éste se agrega más líquido que pasa por el acueducto de Silvio al 4° ventrículo (donde se forma más líquido aún) y de ahí pasa al conducto ependimario de la médula espinal o sale del sistema ventricular por el agujero de Luschka y Magendie, por detrás de los pedúnculos cerebelosos medios. El líquido cefalorraquídeo pasa entonces a rodear la superficie externa del encéfalo y a lo largo de la superficie externa de la médula, en el espacio subaracnoideo.
Figura 27: LCR: Circulación.
El líquido cefalorraquídeo se elimina (Figura 28) vía unas evaginaciones de la aracnoides, sensibles a la presión, que lo transportan a los senos venosos del sistema nervioso central (el flujo global es de unos 500 ml/día). Estas evaginaciones se llaman granulaciones aracnoideas y actúan como válvulas unidireccionales. Si la presión del LCR se hace mayor que la plasmática (en 20 a 50 cm de agua (14,8 – 37 mmHg)) se produce un flujo desde el LCR hacia el seno, pero no ocurre lo contrario. De todas formas el flujo es libre, pues todas las partículas independientemente de su tamaño y carga se depuran a igual velocidad.
Figura 28: LCR: Reabsorción.
Una pequeña parte del líquido es eliminado a nivel de las salidas de los nervios craneanos y raquídeos a través de la duramadre, de manera similar a lo que ocurre con el espacio de Virchow en el globo ocular. Y otra por difusión en los vasos capilares cerebrales.
La formación de LCR es independiente de la presión intracraneal, pero la absorción si depende de dicha presión, en consecuencia a presiones inferiores a 6,8 cm de LCR se anula la absorción, manteniéndose constante la producción, por lo que aumenta la presión intracraneal y se comprimen los vasos intracraneales. A la presión normal intracraneal ( 11,2 cm de LCR)( 7 a 18 cm en lumbar) la producción se equilibra con la absorción.
La disminución del volumen del LCR origina dolor intenso debido a que el tejido cerebral queda suspendido de los vasos sanguíneos subaracnoideos y de los nervios.
El líquido cefalorraquídeo diluye extracelularmente los productos metabólicos de desecho del sistema nervioso central a medida que estos son producidos. También funciona como un amortiguador mecánico del sistema nervioso central, por medio de un sistema hidrostático. Esto permite que el sistema nervioso central sufra aceleraciones y desaceleraciones en su desplazamiento cuando el animal se mueve, sin que esto provoque daños por cambios de presión sobre sus tejidos. El líquido cefalorraquídeo también actúa como medio de comunicación química entre regiones del encéfalo cercanas al sistema ventricular. En estas regiones se liberan distintos neurotransmisores al líquido cefalorraquídeo, que son transportados por el flujo del líquido hasta otras regiones encefálicas donde los neurotransmisores se unen a los receptores de las neuronas que allí se encuentran. Su flujo entre el cráneo y la espina dorsal compensa los cambios en el volumen de sangre intracraneal (la cantidad de sangre dentro del cerebro).
FISIOPATOLOGÍA DE LA BHE, LCR Y CC
Cualquier incremento de volumen de uno de los componentes intracraneales (LCR, sangre y cerebro) supone disminución de los volúmenes del resto o incremento de la PIC."

Figura 29: Fisiopatología de la BHE, LCR y CC
Hidrocefalia: Aumento del volumen del LCR (por obstrucción en su circulación por tumores del tercer o cuarto ventrículos) y/o trastornos en su reabsorción en las granulaciones aracnoideas (meningitis, hemorragia subaracnoidea).
Tumor cerebral: Aumento de la PIC por aumento de la masa neoplásica, edema citotóxico (LIC) y vasogénico (LEC) por aumento de la permeabilidad de la BHE.
Enfermedad pulmonar obstructiva crónica: Por el incremento del PCO2 con vasodilatación cerebral y aumento del volumen sanguíneo.
Craneostenosis: Cierre temprano de las suturas con crecimiento normal cerebral.
Accidente cerebrovascular isquémico: En la región cercana a la isquémica se produce entrada de potasio extracelular y agua en las células gliales (por disminución de la actividad de las bombas de Na/K, por disminución del flujo) y aumento de sodio y agua en las neuronas lo que supone incremento del LIC y por tanto de la PIC. Y una despolarización espontánea por el sodio que aumenta la liberación del neurotransmisor glutamato que facilita más entrada de sodio y agua y calcio, con más aumento del PIC y rotura de la BHE y edema vasogénico y más PIC.
Accidente hemorrágico cerebral.
Estos accidentes se pueden producir por placas de arterioesclerosis obstructivas y también por rotura de arterias pequeñas y capilares debido a un incremento de la presión intravascular.
ENLACES DEL TEMA EN LA WEB
Circulación cerebral (Wikipedia)
Flujo sanguíneo cerebral
Control de la Presión de perfusión cerebral
Presión intracraneal
Barrera hematoencefálica
Líquido cefalorraquídeo
Recolección del LCR
Aumento de la presión intracraneal
VIDEOS EN YOUTUBE
Flujo sanguíneo cerebral
PATOLOGÍA
Accidente cerebrovascular
Aneurisma cerebral
Hemorragia intracerebral
Hemorragia de Duret
Hemorragia subaracnoidea
Hematoma subdural
Isquemia cerebral
Hipoxia cerebral
La barrera hematoencefálica en la patología del sistema nervioso central
Neuromyelitis óptica
Leucoencefalopatía multifocal progresiva
Meningitis
Epilesia
Enfermedad de Vivo
Enfermedad de Alzheimer
Enfermedad del sueño
Esclerosis múltiple
Hidrocefalia
Hidrocefalia normotensiva
FISIOLOGIA. / SISTEMA NERVIOSO/ CIRCULACIÓN CEREBRAL. BARRERA HEMTOENCEFÁLICA
![]()


























 Views Today : 404
Views Today : 404 Views This Month : 13958
Views This Month : 13958 Views This Year : 13958
Views This Year : 13958 Total views : 383105
Total views : 383105
Un comentario en “CIRCULACIÓN CEREBRAL. LA BARRERA HEMATOENCEFÁLICA”