Ingrese su ID de correo electrónico
FISIOLOGIA / SISTEMA ENDOCRINO / EJE HORMONAL SEXUAL MASCULINO / ANDRÓGENOS TESTICULARES
ANDRÓGENOS MASCULINOS - TESTOSTERONA
TESTOSTERONA
LA TESTOSTERONA (Te) ES EL PRINCIPAL ANDRÓGENO CIRCULANTE POR LA SANGRE, QUE PROCEDE DE LOS TESTÍCULOS. ES UN ESTEROIDE CUYA ACCIÓN VARIA DE ACUERDO CON LA ETAPA DEL DESARROLLO DEL SUJETO. ACTUANDO SOBRE EL METABOLISMO Y SOBRE LA SEXUALIDAD.
OBJETIVOS
- Identificar la célula productora de testosterona, su biosíntesis, mecanismos de transporte, metabolismo y eliminación. Enumerar otros andrógenos producidos fisiológicamente.
- Describir los mecanismos de acción de la testosterona.
- Enumerar los órganos o tipos celulares diana de la testosterona y describir sus efectos en cada uno de ellos.
- Identificar las causas y consecuencias del exceso o defecto de secreción de testosterona
- Comparar y contrastar las acciones de la testosterona, dihidrotestosterona, estradiol, y factor inhibidor de Muller.
- Comprender la regulación hormonal de la función gonadal masculina por parte del hipotálamo y la hipófisis, los efectos de las gonadotropinas y el control de su liberación. Describir las funciones de GnRH, FSH, LH, testosterona, activinas, inhibinas, kisspeptina.
TESTOSTERONA. ORIGEN, BIOSÍNTESIS, SECRECIÓN, TRANSPORTE Y METABOLIZACIÓN
El origen de los esteroides sexuales que se pueden medir en el plasma del hombre, es tanto del testículo, como de las suprarrenales, tejido adiposo y tejidos diana donde se produce la activación de estos esteroides (figura 1).
Figura 1: Andrógenos circulantes enn la sangre.
Todos ellos forman parte del eje endocrino sexual masculino (figura 2).
Figura 2: Eje hormonal sexual masculino.
Son esteroides procedentes del colesterol que pertenecen a la familia de los C19 (figura 3).
Figura 3: Esteroides de la familia C19.
La testosterona circulante viene principalmente en el hombre de los testículos (figura 4) y la 5-DHT (dehidrotestosterona) de la transformación de la testosterona en sus tejidos diana. La androstenodiona y el SDHEA (sulfato-dehidroepiandrostenodiona) fundamentalmente de las suprarrenales y el estradiol y la estrona de la aromatización de los andrógenos en tejido adiposo y tejidos diana.
Figura 5: Biosíntesis de la Testosterona.
En las mujeres su origen está en los ovarios (células de la Teca), placenta y cortex adrenal.
En las células de Leydig la unión de la LH a su receptor incrementa el AMPc intracelular y la fosforilación consecuente de la proteíncinasa A (Brooks, 1975[1]Brooks RV (November 1975). "Androgens". Clin Endocrinol Metab 4 (3): 503–20.), la cual activa la captación del colesterol circulante, la biosíntesis de novo del colesterol a partir de la acetil CoA, la desterificación del colesterol y su paso a la mitocondria para su transformación mediada por una desmolasa a pregnenolona, la cual pasa al retículo endoplásmico para su transformación en androstenediona por la vía de la dehidroepiandrosterona y por la vía de la 17-OH-progesterona. La androstenediona pasa a testosterona (Te) que es el principal producto secretado (el 95% de la testosterona circulante). Este proceso es potenciado por la prolactina. (Waterman and Keeney, 1992[2]Waterman MR, Keeney DS (1992). "Genes involved in androgen biosynthesis and the male phenotype". Horm. Res. 38 (5-6): 217–21.).
Las células de Sertoli (localizadas en los túbulos seminíferos), están encargadas del control de la espermatogénesis y aromatizan parte de la testosterona procedente de las células de Leydig convirtiéndola en estradiol. Su función está regulada por la FSH y producen además, una proteína denominada proteína transportadora de andrógenos (ABP) que fija la testosterona en el testículo, facilitando su acción en la espermatogénesis y sirve como transportadora de la misma en el plasma. También producen una pequeña cantidad de Testosterona.
Igualmente, la testosterona y la androstenediona circulantes son aromatizadas respectivamente en estrona y estradiol en el tejido adiposo y tejidos diana.
La secreción de la testosterona varía según la edad sexual del hombre, como puede verse en la gráfica (figura 6). Los demás andrógenos procedentes de las suprarrenales están sujetos a la posible regulación adenohipofisaria de los mismos y respecto a los estrógenos, depende de la masa adiposa del sujeto.
Figura 6: Niveles sanguíneos de testosterona respecto a las etapas de desarrollo del sujeto.
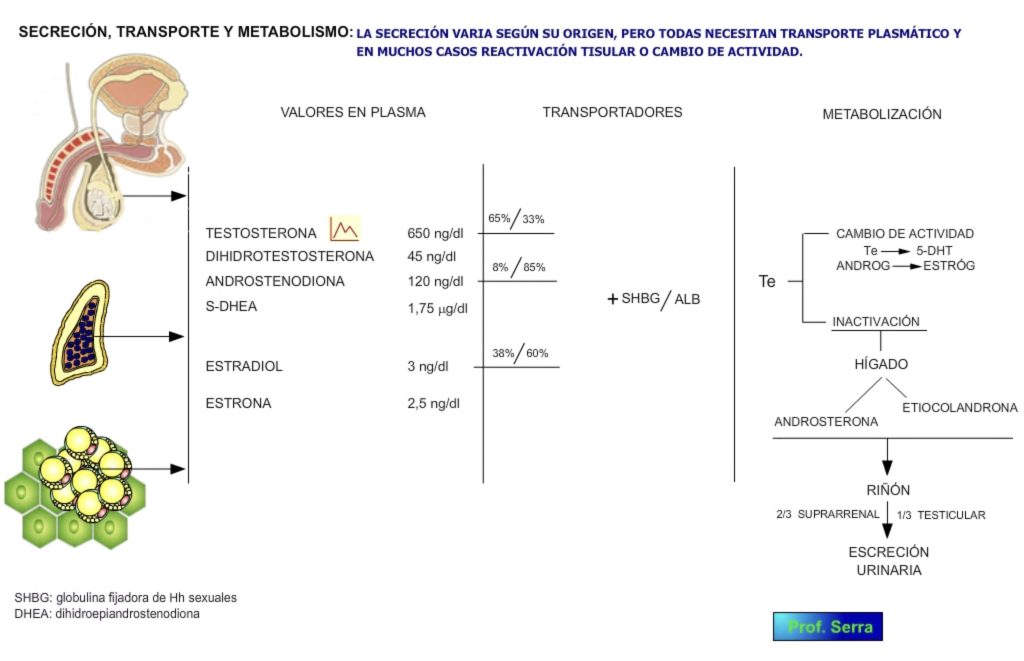
Estos esteroides masculinos circulan en sangre (figura 7) en un 2% libre, el resto va unido en diferentes porcentajes a la globulina fijadora de esteroides sexuales (SHBG) y a la albúmina. Respecto a la testosterona tenemos que diferenciar entre testosterona libre y testosterona biodisponible, pues aunque la libre es solo el 2% y por tanto la que tendría capacidad de actuar, dado que la unión Te-ALB es muy débil y fácilmente separable, aproximadamente un 50% del total tiene capacidad de actuar.
Figura 7: Transporte sanguíneo de los andrógenos.
La Te metabolizable es la libre y la unida a la albúmina. Una pequeña parte es transformada en estrógenos, otra es transformada en un derivado mucho más potente, el 5 dihidrotestosterona y el resto es metabolizada a 17-cetosteroides (androsterona, epiandrosterona y etiocolanolona) con un 20% menos de actividad. La excreción se hace por la orina, donde los 2/3 son de origen suprarrenal y el resto testicular.
TESTOSTERONA. MECANISMO DE ACCIÓN
Figura 8: Mecanismo de acción de la testosterona.
La testosterona ejerce su acción en los tejidos diana de tres formas. Una es directamente sobre sus receptores pertenecientes a la superfamilia de receptores esteroideos, receptores intracelulares que unidos a la hormona ejercen su acción sobre el ADN y su transcripción. Otra es bajo su conversión en 5-DHT mediante la 5 alfa reductasa (de la que se conocen dos tipos localizados en diferentes tejidos, la tipo 1 localizada en piel y cuero cabelludo y la tipo 2, localizada en piel de los genitales, próstata y otros tejidos genitales). Este compuesto tiene mayor actividad y está implicado en acciones importantes dependientes del sexo, como se verá más adelante. Por otra parte la unión Te-R es menos estable que la unión DHT-R.
La última es mediante su aromatización en estradiol, ejerciendo las acciones propias de dicho estrógeno, en algunas de las características dependientes del sexo.
No hay que olvidar el papel potenciador que tiene la prolactina sobre el número de receptores para la testosterona. Y la posibilidad de que la 5-DHT actué sobre receptores de membrana tipo gabaérgico que explicarían algunas de las acciones rápidas de esta hormona.
TESTOSTERONA. ACCIONES
En general la acción de la Testosterona afecta por un lado al metabolismo con efectos anabólicos y por el otro, al sexo con efectos androgénicos. Con efectos importantes para la salud y el bienestar general (Bassil et al., 2009[3]Bassil N, Alkaade S, Morley JE (June 2009). "The benefits and risks of testosterone replacement therapy: a review". Ther Clin Risk Manag 5 (3): 427–48. [Texto completo].).
Sus efectos anabólicos consisten en aumentar la masa ósea (Tuck and Francis 2009[4]Tuck SP, Francis RM (2009). "Testosterone, bone and osteoporosis". Front Horm Res 37: 123–32.) y muscular y su fuerza.
Sus efectos androgénicos consisten en la maduración de los órganos sexuales y desarrollo de gran parte de los caracteres sexuales secundarios.
Estos efectos varían según la edad.
Figura 9: Acciones de los andrógenos.
Durante el desarrollo embrionario la Te procedente de los genitales fetales es imprescindible para el desarrollo en la línea de la masculinización gonadal. Esta esteroidogénesis comienza en las células de Leydig a partir de la 7ª semana de gestación y está bajo el control de la HCG placentaria.
La Te fetal también puede ser responsable de la transformación de las células germinales primordiales en espermatogonias que quedan silentes. Estimula el desarrollo de los conductos de Wolff en rete testis, epidídimo, conducto deferente y vesícula seminal. La 5-DHT estimula el desarrollo del aparato genital externo.
Las células de Sertoli producen un factor inhibidor de los conductos de Müller, que evita su desarrollo en los órganos femeninos (útero, trompas de Falopio y parte superior de la vagina).
La testoterona fetal participa en la conformación de la identidad de género (Swaab & Garcia-Falgueras 2009[5]Swaab DF, Garcia-Falgueras A (2009). "Sexual differentiation of the human brain in relation to gender identity and sexual orientation". Funct. Neurol. 24 (1): 17–28. ).
Tras el nacimiento se produce un incremento de gonadotrofinas producido por la falta de inhibición de los esteroides placentarios. Esto supone un incremento considerable de andrógenos hasta los seis meses postparto (Forest et al., 1973[6]Forest MG, Cathiard AM, Bertrand JA (July 1973). "Evidence of testicular activity in early infancy". J. Clin. Endocrinol. Metab. 37 (1): 148–51.; Corbier et al., 1992[7]Corbier P, Edwards DA, Roffi J (1992). "The neonatal testosterone surge: a comparative study". Arch Int Physiol Biochim Biophys 100 (2): 127–31.). Después los niveles de Te disminuyen a mínimos hasta la época puberal. Esta etapa se inicia por la aparición de pulsos episódicos de GnRH nocturnos.
Los incrementos de Te observados durante el desarrollo fetal y tras el nacimiento parecen estar relacionados, además de con el desarrollo de los órganos sexuales masculinos e inhibición de los femeninos, con la "masculinización" del cerebro (Dankin et als., 2008[8]Dakin CL, Wilson CA, Kalló I, Coen CW, Davies DC (May 2008). "Neonatal stimulation of 5-HT(2) receptors reduces androgen receptor expression in the rat anteroventral periventricular nucleus and sexually dimorphic preoptic area". Eur. J. Neurosci. 27 (9): 2473–80.), donde el cerebro del macho tiene una enzima que aromatiza la Te en estradiol, verdadera responsable de dicha masculinización pues es la única que puede pasar la barrera hematoencefálica sin problemas. En el cerebro de la hembra hay una alfa-fetoproteína que se une al estradiol y evita su acción cerebral. (Ver diferenciación sexual en humanos).
Efectos puberales, con niveles altos de andrógenos que si se mantienen durante un largo tiempo en hembras pueden facilitar su androgenización:
Olor corporal de adulto.
Incremento de las glándulas sebáceas que puede llevar a acné.
Incremento fálico (o clitoromegalia)
Incremento de la líbido y frecuencia de erección.
Extensión del pelo púbico y su conformación masculina.
Desarrollo del pelo facial.
Pérdida de pelo en la cabeza (alopecia androgénica)
Aparición de pelo característico masculino: pecho, periareolar y anal.
Pelo en las piernas.
Pelo axilar.
Grasa subcutánea disminuida en la cara.
Incremento de la masa y fuerza muscular (Bhasin et al., 1996[9]Bhasin S, Storer TW, Berman N, Callegari C, Clevenger B, Phillips J, Bunnell TJ, Tricker R, Shirazi A, Casaburi R (July 1996). "The effects of supraphysiologic doses of testosterone on muscle size and strength in normal men". N. Engl. J. Med. 335 (1): 1–7.).
Profundización de la voz.
Incremento en la altura.
Crecimiento de la nuez.
Crecimiento del tejido espermatogénico, fertilidad masculina.
Remodelación de las facciones masculinas de la cara.
Ampliación de los hombros y de la caja costal.
Finalización de la maduración ósea y término del crecimiento, indirectamente por la vía de los metabolitos del estradiol por lo que es más gradual en hombres que en mujeres.
Durante la etapa adulta, sus efectos son más evidentes en machos que en hembras, pero igual de importante para ambos. Disminuyendo dichos efectos con la edad:
Líbido y frecuencia erectiva tanto del pene como del clítoris.
Regula el eje de los andrógenos suprarrenales (Metha et al., 2008[10]Mehta PH, Jones AC, Josephs RA (June 2008). "The social endocrinology of dominance: basal testosterone predicts cortisol changes and behavior following victory and defeat". J Pers Soc Psychol 94 (6): 1078–93. [Texto completo]).
Proporciona energía mental y física.
Mantiene el trofismo muscular.
Protege contra el cáncer de próstata (Morgentaler and Schulman 2009[11]Morgentaler A, Schulman C (2009). "Testosterone and prostate safety". Front Horm Res 37: 197–203.); Morgentaler, A. and A.M. Traish 2009[12]Morgentaler, A. and A.M. Traish (2009). "Shifting the paradigm of testosterone and prostate cancer: the saturation model and the limits of androgen-dependent growth". Eur Urol 55 (2): 310–20.).
Protege el sistema cardiovascular (Haddad et al., 2007[13]Haddad RM, Kennedy CC, Caples SM, Tracz MJ, Boloña ER, Sideras K, Uraga MV, Erwin PJ, Montori VM (January 2007). "Testosterone and cardiovascular risk in men: a systematic review and meta-analysis of randomized placebo-controlled trials". Mayo Clin. Proc. 82 (1): 29–39. ); Stanworth and Jones 2008[14]Stanworth RD, Jones TH (2008). "Testosterone for the aging male; current evidence and recommended practice". Clin Interv Aging 3 (1): 25–44. [Texto completo]).
Ante un desafío regula la respuesta a la lucha (Mehta and Josephs 2006[15]Mehta PH, Josephs RA (December 2006). "Testosterone change after losing predicts the decision to compete again". Horm Behav 50 (5): 684–92.).
Regula la población de receptores al tromboxano A2, aumentando la agregación plaquetaria (Ajayi and Halushka 2005[16]Ajayi AA, Halushka PV (May 2005). "Castration reduces platelet thromboxane A2 receptor density and aggregability". QJM 98 (5): 349–56.).
Es fundamental en la espermatogénisis.
El desamor disminuye la Te en hombres y la aumenta en mujeres (Marazziti and Canale 2004[17]Marazziti D, Canale D. 2004.Hormonal changes when falling in love. Psychoneuroendocrinology 29(7): 931-936.).
Juega un importante papel en el riesgo frente a la toma de decisiones en los negocios (Sapienza et al., 2009[18]Sapienza P, Zingales L, Maestripieri D (September 2009). "Gender differences in financial risk aversion and career choices are affected by testosterone". Proc. Natl. Acad. Sci. U.S.A. 106 (36): 15268–73.).
La paternidad también disminuye los niveles de la testosterona en los hombres, lo que puede explicar los cambios emocionales y del comportamiento que promueven el cuidado paternal (Berg and Wynne-Edwards 2001[19]Berg SJ, Wynne-Edwards KE. 2001. Changes in testosterone, cortisol, and estradiol levels in men becoming fathers. Mayo Clinic Proceedings 76(1): 582-592.).
En resumen las funciones de los andrógenos son:
La Te es responsable de:
– diferenciación fetal del epidídimo, conducto deferente y vesículas seminales
– crecimiento explosivo puberal (junto a GH y T3)
– aumento del pene y de las vesículas seminales y su secreción
– cierre epifisario, por su transformación en estradiol (Te -> E2)
– capacitación de una erección fisiológicamente completa (potencia)
– inhibe crecimiento glándula mamaria
– agrandamiento de la laringe
– engrosamiento de las cuerda vocales (voz profunda)
– estimula la hematopoyesis (incremento de eritropoyetina renal y acción en medula ósea)
– actividad anabólica (proteica) (balance positivo de nitrógeno), incremento de la masa muscular, ósea y cardiaca.
– regula la liberación de GnRH y LH
– Activa la liberación de GH
La DHT es responsable de:
– estimular los folículos pilosos (barba, vello pubiano en forma de rombo, pelo corporal, regresión de la línea temporal del pelo)
– incrementa la producción de sebo (acné)
– diferenciación del pene, escroto, uretra peneana y próstata en el feto
– crecimiento del pene y vesículas seminales en la pubertad
– en la pubertad crecimiento del escroto y próstata y sus secreciones
– incrementa el espesor de la piel
– estimula la fijación de calcio en el hueso y su espesor
Los andrógenos producen retención moderada de sodio, potasio, agua, sulfato y fósforo, y aumentan el tamaño de los riñones.
Las tres juntas:
– regulan la espermatogénesis
Figura 10: Espermatogénesis.
– estimulan el comportamiento agresivo, activo y el interés por el sexo opuesto y la conducción sexual (libido), junto con otras hormonas como la oxitocina y la vasotocina. Importante componente de aprendizaje.
TESTOSTERONA. REGULACIÓN
El comienzo de la pubertad coincide con una liberación pulsátil de GnRH y por tanto de LH (cada 60 minutos), provocada por la liberación de la KISSPEPTINA, señal de origen hipotalámico (núcleo arqueado en el varón) cuya aparición marca la señal de inicio de la pubertad, actuando sobre las neuronas secretoras de GnRH, liberación que se mantiene durante la etapa adulta. La señal de su activación, es la leptina del tejido adiposo que indica el nivel adecuado de reserva grasa en el sujeto. Estas secreciones pulsátiles también afectan a la testosterona. Junto a este tipo de liberación se superpone una secreción circadiana con un pico máximo hacia las 20.00 h y un mínimo hacia las 8.00 h. La FSH sin embargo no presenta estos tipos de ritmos.
Figura 11: Regulación de la secreción de la Testosterona.
Existe un retrocontrol negativo entre la testosterona y la LH y entre la inhibina, la folistatina(Robertson, 1992[20]Robertson DM (1992). "Follistatin/activin-binding protein". TEM 3:65-68.)y la FSH. La testosterona disminuye la frecuencia de descarga de LH (actúa al nivel del hipotálamo), mientras que el estradiol disminuye la amplitud de descarga de la LH (actúa en el nivel de la hipófisis). Tanto la LH como la FSH son hormonas tróficas para las células de Leydig y las de Sertoli respectivamente. La FSH estimula y mantiene la espermatogénesis y estimula la síntesis y liberación en las células de Sertoli de otros moduladores como las inhibinas y las activinas, así como de la transformación de testosterona en estrógenos necesarios también para la maduración de los espermatozoides. La testosterona liberada por las células de Leydig pasa al túbulo seminífero donde es almacenada por las ABP, siendo esenciales para la maduración de los espermatozoides.
La prolactina actúa de forma sinérgica con la LH en la producción de testosterona y a su vez tanto la testosterona como el estradiol estimulan la síntesis de prolactina. Por otra parte la prolactina potencia la acción de la testosterona en sus tejidos diana, incrementando el número de receptores para los andrógenos.
La hormona del crecimiento tiene un efecto similar a la prolactina. La insulina potencia la acción de la LH/GCh.
La IGF1 producida por las mismas células de Sertoli y de Leydig, regula la proliferación y desarrollo testicular.
El factor beta de crecimiento tumoral (TGF-beta), producido por las células tecales y de Leydig y peritubulares, inhibe el número de receptores para la LH. Así mismo, el PDGF (factor de crecimiento derivado de plaquetas), estimula a las células de Sertoli.
Además de lo anterior se sabe que la pérdida de estatus o dominación social supone una disminución de Te (Mehta and Josephs 2006[21]Mehta PH, Josephs RA (December 2006). "Testosterone change after losing predicts the decision to compete again". Horm Behav 50 (5): 684–92.. También la motivación implícita del poder lleva a un aumento de la Te (Schultheiss, 1999[22]Schultheiss OC, Campbell KL, McClelland DC (December 1999). "Implicit power motivation moderates men’s testosterone responses to imagined and real dominance success". Horm Behav 36 (3): 234–41.).
El incremento de la edad reduce los niveles de Te (Liu et al., 2006[23]Liu PY, Pincus SM, Takahashi PY, Roebuck PD, Iranmanesh A, Keenan DM, Veldhuis JD (January 2006). "Aging attenuates both the regularity and joint synchrony of LH and testosterone secretion in normal men: analyses via a model of graded GnRH receptor blockade". Am. J. Physiol. Endocrinol. Metab. 290 (1): E34–E41.).
El sueño REM incrementa los niveles de Te (Andersen & Tufik, 2008[24]Andersen ML, Tufik S (October 2008). "The effects of testosterone on sleep and sleep-disordered breathing in men: its bidirectional interaction with erectile function". Sleep Med Rev 12 (5): 365–79. [Texto completo]), incrementados también por el entrenamiento de resistencia (Marin et al., 2006[25]Marin DP, Figueira AJ Junior, Pinto LG.(2006) "One session of resistance training may increase serum testosterone and triiodetironine in young men". Medicine & Science in Sports & Exercise 38 (5): S285.), aunque en hombres mayores este tipo de incremento puede ser evitado por la ingestión de proteínas (Hulmi et al., 2008[26]Hulmi JJ, Ahtiainen JP, Selänne H, Volek JS, Häkkinen K, Kovanen V, Mero AA (May 2008). "Androgen receptors and testosterone in men–effects of protein ingestion, resistance exercise and fiber type". J. Steroid Biochem. Mol. Biol. 110 (1-2): 130–7.).
Las deficiencias de Zinc bajan los niveles de Te (Prasad et al., 1996[27] Prasad AS, Mantzoros CS, Beck FW, Hess JW, Brewer GJ (May 1996). "Zinc status and serum testosterone levels of healthy adults". Nutrition 12 (5): 344–8.) y su suplemento en exceso no los mejora (Koehler et al., 2009[28]Koehler K, Parr MK, Geyer H, Mester J, Schänzer W (January 2009). "Serum testosterone and urinary excretion of steroid hormone metabolites after administration of a high-dose zinc supplement". Eur J Clin Nutr63 (1): 65–70.). También hay evidencias de que el ácido glicirrhizinico del regaliz disminuye, pero poco, la Te en la mujer (Armanini et al., 2004[29]Armanini D, Mattarello MJ, Fiore C, Bonanni G, Scaroni C, Sartorato P, Palermo M (2004). "Licorice reduces serum testosterone in healthy women". Steroids 69 (11-12): 763–6.), y también en el hombre aunque clínicamente no es significativo (Josephs et al., 2001[30]Josephs RA, Guinn JS, Harper ML, Askari F (November 2001). "Liquorice consumption and salivary testosterone concentrations". Lancet 358 (9293): 1613–4.). También el té de menta verde reduce los niveles de testosterona (Grant, 2010[31]Grant P (February 2010). "Spearmint herbal tea has significant anti-androgen effects in polycystic ovarian syndrome. A randomized controlled trial". Phytother Res 24 (2): 186–8.)(Kumar et al., 2008[32]Kumar V, Kural MR, Pereira BM, Roy P (December 2008). "Spearmint induced hypothalamic oxidative stress and testicular anti-androgenicity in male rats – altered levels of gene expression, enzymes and hormones". Food Chem. Toxicol. 46 (12): 3563–70.).
TESTOSTERONA. ALTERACIONES
Las alteraciones en los diferentes niveles del eje son por defecto o por exceso y su efecto siempre dependerá de si ocurren antes o después de la pubertad.

Figura 12: Alteraciones en la secreción de la Testosterona.
Antes de la pubertad pueden llevar a retraso en su activación o a no alcanzarla nunca (hipogonadismo), o todo lo contrario a alcanzar antes de tiempo, con los problemas que ello acarrea en cuanto al cierre epifisario óseo. Si ocurre en el desarrollo embrionario se condicionaría una femenización de los genitales externos.
Después de la pubertad, un déficit hormonal supondrá entre otros efectos una posible infertilidad dado el papel de las hormonas sexuales, entre otras, para la espermatogénesis (oligospermia (baja concentración de espermatozoides), azospermia (ausencia de espermatozoides).
ENLACES DEL TEMA EN LA WEB
Wikipedia-en (andrógenos)
Wikipedia-en (testosterona)
Información Medline Plus Medical sobre testosterona
Información Medline Plus Medical sobre los andrógenos
Testosterona sérica
Antígeno prostático específico (PSA)
17-cetosteroides en una muestra de orina
Andropausia
Kisspeptina
Testosterone link to aggression may be all in the mind
VIDEOS EN YOUTUBE
Vídeo: Hormonas, cerebro, pubertad
Vídeo: testosterona y competitividad: diferencias de género
PATOLOGÍA
Cáncer de próstata
Tumor de células de Sertoli-Leydig
Síndrome de Morris
Síndrome de insensibilidad a los andrógenos
BIBLIOGRAFÍA GENERAL
S. Constantin. (2011) Physiology of the GnRH neuron: Studies from embryonic GnRH neurons. Journal of Neuroendocrinology
FISIOLOGIA / SISTEMA ENDOCRINO / EJE HORMONAL SEXUAL MASCULINO / ANDRÓGENOS TESTICULARES
![]()










 Views Today : 172
Views Today : 172 Views This Month : 15271
Views This Month : 15271 Views This Year : 30049
Views This Year : 30049 Total views : 399196
Total views : 399196